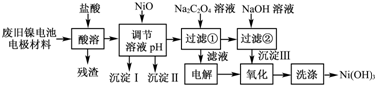
题目内容
8.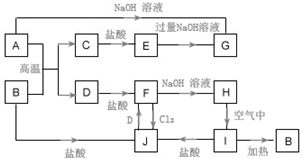 A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.
A~J为中学化学的常见物质,它们之间有如图所示的转化关系(部分产物已略去).已知A、D为金属单质,B为红棕色粉末,I为红褐色固体.请回答下列问题:
(1)物质G的化学式为NaAlO2.
(2)反应I→B的化学方程式2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2O.
(3)反应H→I的现象为白色沉淀迅速变为灰绿色,最后生成红褐色沉淀.
(4)反应F→J的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(5)向J的溶液中加入一定量金属D充分反应,D完全溶解.得到溶液X.某同学对溶液X中所含的金属离子进行以下探究:
①提出合理假设:
假设1:若J部分反应,则溶液X中含有的金属离子为Fe2+、Fe3+.
假设2:若J与D恰好完全反应,则溶液X中含有的金属离子为Fe2+.
②探究过程及结论:
取少许溶液X于试管中,滴加KSCN 溶液.若观察到的现象为溶液变红色,则证明假设1成立;若无明显现象,则证明假设2成立.
分析 I为红褐色固体,B为红棕色粉末,加热I分解生成B,则I为Fe(OH)3,B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.金属D与J反应生成F,F与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则D为Fe,F为FeCl2,H为Fe(OH)2.金属A与B的反应生成C与D,则C为金属氧化物,C系列转化得到G,而A能与氢氧化钠反应也得到G,故A为Al,C为Al2O3,E为AlCl3,G为NaAlO2,据此解答.
解答 解:I为红褐色固体,B为红棕色粉末,加热I分解生成B,则I为Fe(OH)3,B为Fe2O3,I与盐酸反应生成J,则J为FeCl3.金属D与J反应生成F,F与氢氧化钠反应生成H,H在空气中转化为氢氧化铁,则D为Fe,F为FeCl2,H为Fe(OH)2.金属A与B的反应生成C与D,则C为金属氧化物,C系列转化得到G,而A能与氢氧化钠反应也得到G,故A为Al,C为Al2O3,E为AlCl3,G为NaAlO2.
(1)物质G的化学式为:NaAlO2,故答案为:NaAlO2;
(2)反应I→B的化学方程式:2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2O,故答案为:2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2O;
(3)反应H→I是氢氧化亚铁被氧化为氢氧化铁,反应的现象为:白色沉淀迅速变为灰绿色,最后生成红褐色沉淀,故答案为:白色沉淀迅速变为灰绿色,最后生成红褐色沉淀;
(4)反应F→J的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)向FeCl3的溶液中加入一定量金属Fe充分反应,发生反应:2Fe3++Fe=3Fe2+,Fe完全溶解:
①假设1:若FeCl3部分反应,溶液X一定含有FeCl2、未反应的FeCl3,则溶液X中含有的金属离子为:Fe2+、Fe3+,
假设2:若FeCl3与Fe恰好完全反应,溶液X只含有FeCl2,不含FeCl3,则溶液X中含有的金属离子为:Fe2+,
故答案为:Fe2+、Fe3+;Fe2+;
②取少许溶液X于试管中,滴加KSCN溶液.若观察到溶液变红色,则证明假设1成立;若无明显现象,则证明假设2成立,
故答案为:KSCN;溶液变红色.
点评 本题考查无机物推断、元素化合物的性质等,难度中等,B、I颜色为推断突破口,需要学生熟练元素化合物的性质,注意基础知识的积累掌握.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案| A. | 纯碱属于碱 | B. | 钢属于纯净物 | ||
| C. | 冰醋酸属于混合物 | D. | 水属于氧化物 |
| A. | 石油、煤和天然气都是重要的化石燃料 | |
| B. | 淀粉、蔗糖和蛋白质均能发生水解反应 | |
| C. | 羊毛、塑料和橡胶均属于合成高分子材料 | |
| D. | 糖类、油脂和蛋白质都含有C、H、O三种元素 |
| A. | 用分液漏斗分离水和乙醇的混合物 | |
| B. | 可用湿润的淀粉碘化钾试纸检验氯气 | |
| C. | 用氢氧化钠溶液除去二氧化碳气体中的氯化氢 | |
| D. | 某溶液焰色反应的火焰呈黄色,说明该溶液中只含有钠离子不含钾离子 |
| A. | 按系统命名法,化合物CH3CH(CH2CH3)2名称3-甲基戊烷 | |
| B. | 用新制的Cu(OH)2悬浊液可以鉴别乙酸、乙醇和葡萄糖 | |
| C. | 有机物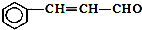 可发生加成反应、氧化反应、还原反应和聚合反应 可发生加成反应、氧化反应、还原反应和聚合反应 | |
| D. | 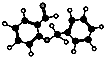 图所示的有机物分子式为C14H12O2,不能发生银镜反应 图所示的有机物分子式为C14H12O2,不能发生银镜反应 |
| A. | 硅元素主要以单质、氧化物、硅酸盐的形式存在于自然界 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 医药中,常用酒精来消毒,是因为酒精能够使细菌蛋白质发生变性 | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
| A. | 漂白粉为纯净物 | B. | 光导纤维为氧化物 | ||
| C. | 氧化钠为碱性氧化物 | D. | 淀粉溶液属于胶体 |