题目内容
3.重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这 给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清 夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐.Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=2.5×10-9
(1)写出沉淀转化的方程式:BaSO4(s)+Na2CO3 (aq)?BaCO3(s)+Na2SO4(aq),此反应平衡常数K 的值为0.04.
(2)要实现该转化C(CO32-)不低于2.5×10-4 mol/L
(3)必须更换Na2CO3溶液的原因是什么?保证Na2CO3溶液的浓度不低于2.5×10-4mol/L.
分析 (1)BaSO4电离出的钡离子与碳酸根离子结合生成碳酸钡沉淀;平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,结合Ksp(BaSO4)、Ksp(BaCO3)计算;
(2)根据Ksp(BaSO4)计算饱和溶液中硫酸根离子的浓度,再根据平衡常数计算c(CO32-);
(3)当Na2CO3溶液的浓度太低时转化不再发生.
解答 解:(1)用饱和Na2CO3溶液处理BaSO4沉淀,BaSO4电离出的钡离子与碳酸根离子结合生成碳酸钡沉淀,其转化的方程式为:BaSO4(s)+Na2CO3 (aq)?BaCO3(s)+Na2SO4(aq);该反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(B{a}^{2+})×c(S{{O}_{4}}^{2-})}{c(B{a}^{2+})×c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.0×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.04;
故答案为:BaSO4(s)+Na2CO3 (aq)?BaCO3(s)+Na2SO4(aq);0.04;
(2)已知Ksp(BaSO4)=1.0×10-10,则饱和硫酸钡溶液中硫酸根离子的浓度c(SO42-)=$\sqrt{Ksp(BaS{O}_{4})}$=1.0×10-5mol/L,
则c(CO32-)=$\frac{c(S{{O}_{4}}^{2-})}{K}$=$\frac{1.0×1{0}^{-5}}{0.04}$=2.5×10-4mol/L;
故答案为:2.5×10-4;
(3)当Na2CO3溶液的浓度太低时转化不再发生,要保证Na2CO3溶液的浓度不低于1.25×10-3mol/L,必须更换Na2CO3溶液;
故答案为:保证Na2CO3溶液的浓度不低于1.25×10-3mol/L.
点评 本题考查了沉淀的转化、平衡常数的计算、溶度积的计算等,题目难度中等,侧重于考查学生的计算能力和分析能力.

| A. | H2O+H2O═H3O++OH- | |
| B. | CO32-+2H2O?H2CO3+2OH- | |
| C. | Ca(OH)2+2H+?Ca2++2H2O | |
| D. | 2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
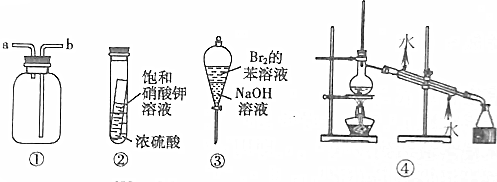
| A. | 装置①可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 实验②放置一段时间后,小试管内有晶体析出 | |
| C. | 实验③振荡后静置,上层溶液颜色变浅 | |
| D. | 实验④可用于分离饱和Na2CO3溶液和CH3COOC2H5 |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)方法Ⅰ制备过程会产生有毒气体,每生成1g该有毒气体,能量变化a kJ,写出制备反应的热化学方程式2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=+28akJ•mol-1.
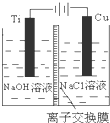
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为2Cu-2e-+2OH-=Cu2O+H2O.
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O.
(5)方法Ⅲ可以用甲醛稀溶液替代肼,但因反应温度较高而使部分产品颗粒过大,过滤(填操作名称)可分离出颗粒过大的Cu2O.
(6)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的Cu2O分别进行催化分解水的实验:2H2O(g)$\frac{\underline{\;光照\;}}{Cu_{2}O}$2H2(g)+O2(g)△H>0水蒸气的浓度(mol•L-1)随时间t(min)变化如下表:
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
②取等量①的滤液于两支试管中,分别滴加等浓度等体积的Na2S溶液、Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.
③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.
下列分析不正确的是( )
| A. | ①中生成AgCl沉淀,溶液中c(Ag+)和c(Cl-)大量减少 | |
| B. | ①的滤液中不含有Ag+ | |
| C. | ②的现象说明该温度下Ag2S比Ag2SO4更难溶 | |
| D. | ③中生成Ag(NH3)2+,使c(Ag+)减小,促进AgCl(s)溶解平衡正向移动 |
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(2)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形;
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
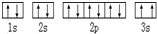 ,该同学所画的电子排布图违背了泡利原理;
,该同学所画的电子排布图违背了泡利原理;(4)D是P,E是Cl(填元素符号);
(5)G位于第Ⅷ族,G3+电子排布式为ls22s22p63s23p63d5;
(6)第二、三、四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式)LiCl>NaCl>KCl,原因是LiCl、NaCl、KCl均为离子晶体,因为Li+、Na+、K+的半径依次增大,LiCl、NaCl、KCl的晶格能依次减小,故熔点依次降低.
| A. | 氟离子的结构示意图: | B. | 甲烷的比例模型: | ||
| C. | NaCl的电子式: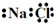 | D. | 乙炔的结构简式:CHCH |