题目内容
8.25℃时,5种银盐的溶度积常数(Ksp)分别是:| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀 | |
| C. | 在5mL1.8×10-5 mol/L的NaCl溶液中,加入1滴(1mL约20滴)0.1 mol/L的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成 |
分析 A.结构相似的难溶性盐,溶度积越小,溶解度越小;
B.硫化银的溶度积比硫酸银小,从沉淀平衡移动的角度分析;
C.根据溶度积计算,当离子的浓度幂之积大于Ksp时,能生成沉淀,否则不生成沉淀;
D.当离子的浓度幂之积大于Ksp时,能生成沉淀.
解答 解:A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.c(Cl-)=1.8×10-5mol/L×$\frac{5}{5+0.05}$,c(Ag+)=0.1mol/L×$\frac{0.05}{5+0.05}$,
则c(Cl-)×c(Ag+)=1.8×10-5mol/L×$\frac{5}{5+0.05}$×0.1mol/L×$\frac{0.05}{5+0.05}$>1.8×10-10(mol/L)2,能析出沉淀,故C错误;
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡问题,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据溶度积计算,理解溶度积的意义,比较溶解度与溶度积之间的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.实验室制备间硝基苯胺的反应方程式、操作步骤、部分参考数据及装置图如图: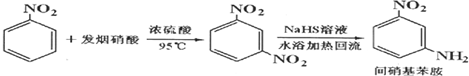
(发烟硝酸是溶有NO2的98%的浓硝酸)
①在圆底烧瓶中加入原料,加热搅拌使充分反应;
②将反应物倒入盛有碎冰的烧杯,待冷却结晶后倾倒出酸液,对剩余混合物进行抽滤;
③将滤出固体溶于甲醇,置于烧瓶中按照图1装置安装,并加入NaHS溶液,加热;
④反应充分后改为蒸馏装置(图2)蒸出溶剂,将残留液体倒入冷水,抽滤洗涤烘干.
已知:偶极矩可表示分子受固定相吸附的能力,越大吸附力越强请回答下列问题:

(1)步骤①中反应前期加热温度如超过95℃,易造成原料损失,故加热方式应为水浴加热;
(2)步骤②中抽滤的同时需用饱和Na2CO3溶液对固体进行洗涤,目的是洗去产物中混有的酸性物质,简述洗涤的操作过程在布氏漏斗中倒入饱和Na2CO3溶液至浸没固体后抽滤,重复若干次;
(3)步骤③装置(图1)中a仪器名称为干燥管,其中填充有碱石灰,作用是吸收挥发出的硝酸、NO2等酸性物质;
(4)关于步骤④装置(图2)相关叙述错误的是BCD;
A.冷凝水流向错误,应为低流进高流出
B.锥形瓶中首先收集到的液体为蒸馏水
C.温度计水银球位置偏低,应在液面以上,紧贴液面以迅速测定气体组分的温度
D.图1、2装置中b、c均有冷凝效果,故步骤④可在图1装置中直接完成蒸馏,无需改为图2装置
(5)最终得到的产品中含有少量邻硝基苯胺、对硝基苯胺以及硝基苯杂质,根据固定相对各组分在流动过程中的吸附能力大小可混合物分离.图3所示为混合物,已知C为间硝基苯胺,写出B的结构简式 ;
;
(6)之后该同学设计的提纯装置如图4:在一根底部带有旋塞的玻璃管内装满固定相,将流动相与样品混合后从上端倒入,并持续倒入流动相,一段时间后发现管内出现如图四段黄色色带,则本实验所需收集的产物组分主要集中在色带层② (填编号)上.

(发烟硝酸是溶有NO2的98%的浓硝酸)
①在圆底烧瓶中加入原料,加热搅拌使充分反应;
②将反应物倒入盛有碎冰的烧杯,待冷却结晶后倾倒出酸液,对剩余混合物进行抽滤;
③将滤出固体溶于甲醇,置于烧瓶中按照图1装置安装,并加入NaHS溶液,加热;
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |
已知:偶极矩可表示分子受固定相吸附的能力,越大吸附力越强请回答下列问题:

(1)步骤①中反应前期加热温度如超过95℃,易造成原料损失,故加热方式应为水浴加热;
(2)步骤②中抽滤的同时需用饱和Na2CO3溶液对固体进行洗涤,目的是洗去产物中混有的酸性物质,简述洗涤的操作过程在布氏漏斗中倒入饱和Na2CO3溶液至浸没固体后抽滤,重复若干次;
(3)步骤③装置(图1)中a仪器名称为干燥管,其中填充有碱石灰,作用是吸收挥发出的硝酸、NO2等酸性物质;
(4)关于步骤④装置(图2)相关叙述错误的是BCD;
A.冷凝水流向错误,应为低流进高流出
B.锥形瓶中首先收集到的液体为蒸馏水
C.温度计水银球位置偏低,应在液面以上,紧贴液面以迅速测定气体组分的温度
D.图1、2装置中b、c均有冷凝效果,故步骤④可在图1装置中直接完成蒸馏,无需改为图2装置
(5)最终得到的产品中含有少量邻硝基苯胺、对硝基苯胺以及硝基苯杂质,根据固定相对各组分在流动过程中的吸附能力大小可混合物分离.图3所示为混合物,已知C为间硝基苯胺,写出B的结构简式
 ;
;(6)之后该同学设计的提纯装置如图4:在一根底部带有旋塞的玻璃管内装满固定相,将流动相与样品混合后从上端倒入,并持续倒入流动相,一段时间后发现管内出现如图四段黄色色带,则本实验所需收集的产物组分主要集中在色带层② (填编号)上.
13.BaSO4在下列物质中溶解度最大的是( )
| A. | 纯水 | B. | 稀硫酸 | C. | 氯化钡溶液 | D. | 硫酸钠溶液 |
20.在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(g)+B(g)?2C(g)△H<0
2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
| A. | 若反应开始时容器体积为2 L,则v(C)=0.4mol•L-1•min-1 | |
| B. | 若该反应在恒温恒容下进行,放出热量将增加 | |
| C. | 若2 min后,向容器中再投入等物质的量A、C,则B的转化率不变 | |
| D. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
18.下列关于反应速率和反应限度的说法中,错误的是( )
| A. | 化学反应限度可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 可逆反应达到反应限度(化学平衡)时,正、逆反应速率相等 | |
| D. | 可以通过改变外界条件控制化学反应的限度 |
