题目内容
11.在稀硫酸中插一块铜片,再加入下列某一物质后,可使铜片迅速发生反应的是( )| A. | 硝酸钾晶体 | B. | 硫酸钠晶体 | C. | 氯化钡晶体 | D. | 氯化钠晶体 |
分析 铜与非氧化性酸在常温下不能发生反应,但可以和强氧化性酸反应,硝酸根离子在酸性环境下具有强的氧化性,据此解答.
解答 解:A.加入硝酸钾,酸性条件下,硝酸根具有强氧化性,能够氧化铜,发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故A正确;
B.铜与稀硫酸、硫酸钠都不会发生反应,铜片不溶解,故B错误;
C.铜与稀硫酸、氯化钡都不发生反应,铜片不溶解,故C错误;
D.铜与硫酸、盐酸、钠离子不反应,铜片不溶解,故D错误;
故选:A.
点评 本题考查了铜、硝酸的化学性质,难度不大,掌握物质的性质是解题的关键,注意硝酸根离子在酸性环境下具有强的氧化性,题目难度不大.

练习册系列答案
相关题目
1.下列化学用语正确的是( )
| A. | 聚乙烯的结构简式: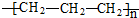 | B. | 丙烷分子的比例模型: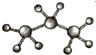 | ||
| C. | 四氯化碳分子的电子式: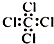 | D. | 2-乙基-1,3-丁二烯分子的键线式: |
2.A、B、C、D为短周期元素,在周期表中的相对位置如表所示,且A、B原子序数之和与D的原子序数相等.有关说法正确的是( )
| A | B |
| C | D |
| A. | 原子半径:C>A=D>B | |
| B. | 最高价氧化物对应的水化物酸性:B>D | |
| C. | 气态氢化物的稳定性:C>D>B | |
| D. | C的气态氢化物的水溶液在空气中放置会出现浑浊现象,可以说明非金属性A>C |
19.在下列影响化学反应速率的外界因素中,肯定能增大化学反应速率的是( )
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
①升高温度 ②加入正催化剂 ③增加反应物的量④将固体块状反应物磨成粉末 ⑤增大压强.
| A. | 只有①②④ | B. | 只有②④ | C. | 只有①②③④ | D. | 全部 |
6.X、Y、Z、W四种金属片在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:则四种金属的活泼性由强到弱的顺序为( )
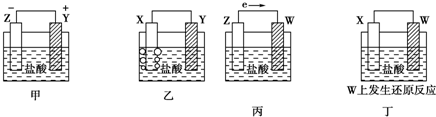

| A. | Z>Y>X>W | B. | Z>X>Y>W | C. | Z>Y>W>X | D. | Y>Z>X>W |
16.原子序数11~17号的元素,随着核电荷数的递增而逐渐变小的是( )
| A. | 电子层数 | B. | 原子半径 | ||
| C. | 原子的最外层电子数 | D. | 元素最高化合价 |
3.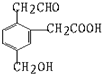 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
 某有机物的结构式为它在一定条件下(如图)能发生的反应有( )
某有机物的结构式为它在一定条件下(如图)能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
20.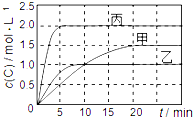 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
1.下列有关反应热测定实验叙述正确的是( )
| A. | 盖斯定律为我们提供了解决很难由实验直接测定而获得反应热的理论依据 | |
| B. | 若用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时只需要记录反应体系的最高温度t即可 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,再用环形玻璃搅拌棒不断搅拌 |