题目内容
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)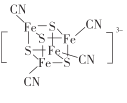 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
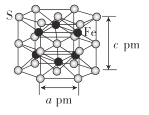
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
【答案】![]() 哑铃(或纺锤) 3:1 S和C 4 三角锥形 sp3 ACD
哑铃(或纺锤) 3:1 S和C 4 三角锥形 sp3 ACD 
【解析】
(1) Fe为26号元素,其基态Fe原子价电子为3d64s2,基态S原子的核外电子占据最高能级是3p能级。
(2)团簇离子中,设Fe2+、Fe3+数目分别为x、y,建立方程计算;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,根据图中结构得出铁的配位数。
(3)①计算NF3的价层电子对数,得到中心原子的杂化方式,得到价层电子互斥理论模型,由于有1对孤对电子,因此得到空间构型;②A. NF4BF4中N—F,B—F之间为σ键;B. NF4BF4中N—F,B—F之间为单键,无π键;C. NF4BF4中NF4+、BF4-之间是离子键;D. NF4+、BF4-里都存在配位键。
(4)根据图分析得出S个数和Fe个数,再根据公式计算该化合物晶体的密度。
(1) Fe为26号元素,其基态Fe原子价电子为3d64s2,因此基态Fe原子价电子排布图为![]() ;基态S原子的核外电子占据最高能级是3p能级,其电子云轮廓图为哑铃(或纺锤)形;故答案为:
;基态S原子的核外电子占据最高能级是3p能级,其电子云轮廓图为哑铃(或纺锤)形;故答案为:![]() ;哑铃(或纺锤)。
;哑铃(或纺锤)。
(2) 团簇离子中,设Fe2+、Fe3+数目分别为x、y,因此x+y=4,2x + 3y+(2)×4+(1)×4 = 3,解得x =3,y=1,因此Fe2+、Fe3+数目之比为3:1;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,因此与铁形成配位键的原子是S、C;根据图中结构得出铁的配位数为4;故答案为:3:1;S、C;4。
团簇离子中,设Fe2+、Fe3+数目分别为x、y,因此x+y=4,2x + 3y+(2)×4+(1)×4 = 3,解得x =3,y=1,因此Fe2+、Fe3+数目之比为3:1;S与Fe形成三个价键,S最外层有6个电子,易形成2个价键,另外一个价键与Fe形成配位键,CN-中C有孤对电子,与Fe形成配位键,因此与铁形成配位键的原子是S、C;根据图中结构得出铁的配位数为4;故答案为:3:1;S、C;4。
(3)①NF3的价层电子对数![]() ,中心原子的杂化方式是sp3,价层电子互斥理论模型为四面体形,由于有1对孤对电子,因此空间构型为三角锥形;故答案为:三角锥形;sp3。
,中心原子的杂化方式是sp3,价层电子互斥理论模型为四面体形,由于有1对孤对电子,因此空间构型为三角锥形;故答案为:三角锥形;sp3。
②A. NF4BF4中N—F,B—F之间为σ键,故A符合题意;B. NF4BF4中N—F,B—F之间为单键,无π键,故B不符合题意;C. NF4BF4中NF4+、BF4-之间是离子键,故C符合题意;D. NF4+、BF4-里都存在配位键,故D符合题意;综上所述,答案为ACD。
(4)根据图分析得出S个数![]() ,Fe个数为6个,化学式为FeS,晶体的结构如图所示,六棱柱底边边长为a pm,底边面积为高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为
,Fe个数为6个,化学式为FeS,晶体的结构如图所示,六棱柱底边边长为a pm,底边面积为高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为 ;故答案为:
;故答案为: 。
。