题目内容
【题目】下列说法不正确的是( )
A. 浓硝酸必须保存在棕色瓶中 B. 铵盐应密封保存于阴凉处
C. pH=6的降雨是酸雨 D. SO2、NO2、可吸入颗粒物等过量排放导致雾霾
【答案】C
【解析】A.浓硝酸不稳定,风光易分解,须保存在棕色瓶中,故A正确;B.铵盐不稳定,受热分解,应密封保存于阴凉处,故B正确;C.正常雨水的pH约为5.6,溶解二氧化硫的雨水为酸雨,酸雨的pH<5.6,故C错误;D.固体颗粒的排放可导致雾霾,则SO2、NO2、可吸入颗粒物等过量排放导致雾霾,故D正确;故选C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合时体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. 在①②中分别加入氯化铵晶体,两溶液的pH值均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①④两溶液等体积混合后所得溶液显酸性
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
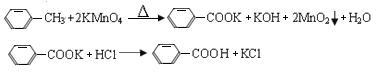
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
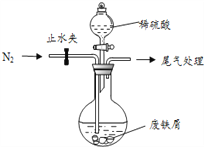
主要实验装置和流程如下:
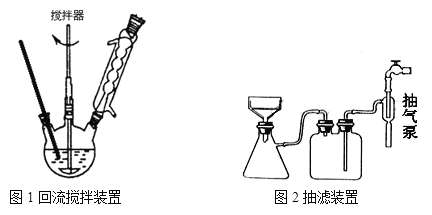
实验方法:一定量的甲苯和KMnO4溶液里于图l 装置中,在90℃时,反应一段时间后,
停止反应,按如下流程分离出苯甲酸并回收未反应的甲苯。
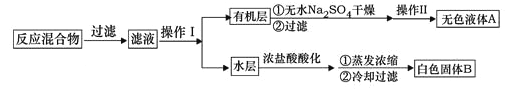
(1)白色固体B中主要成分的分子式为________。操作Ⅱ为________。
(2)如果滤液呈紫色,需加入亚硫酸氢钾,用离子方程式表示其原因__________。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图 回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(4)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(5)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL 溶液,进行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为_______。
【题目】碳酸锂广泛应用于化工、冶金等行业。工业上利用锂辉石(Li2Al2Si4Ox)制备碳酸锂的流程如下:
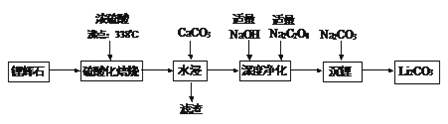
已知:①CaC2O4难溶于水
②Li2CO3的溶解度(g/L)
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
请回答下列问题:
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成,形式为___________。
(2)硫酸化焙烧温度不宜超过300℃,主要原因是___________________;焙烧中硫酸用量控制在理论用量的115%左右,硫酸加入过多的副作用是____________。
(3)“深度净化”时,加入适量Na2C2O4的目的是__________________。
(4)“沉锂”需要在95℃以上进行,主要原因是____________________________。
(5)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________,宜选用_____(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是________________________。