题目内容
【题目】我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N2 0.6mol,H2 0.5mol,在一定温度下进行反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
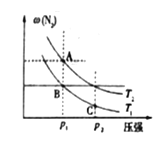
a.A、B、C三点的平衡常数大小关系:KA<KB<KC
b.A点和B点混合气体的密度大小关系:A<B
c.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图所示:
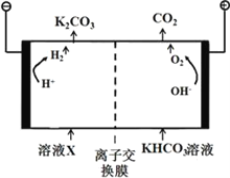
①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理___________________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,
工业上利用该反应合成甲醇。已知:25℃,101KPa下:
2H2(g)+O2(g)=2H2O(g) ΔH1=—484kJ/mol
2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(g) ΔH2=—1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________。
【答案】—92 10 逆向 b 4OH--4e-=O2↑ +2H2O 溶液中HCO3-存在电离平衡:HCO3-![]() CO32-+H+,阴极H+放电,c(H+)减少平衡右移CO32-再生(或阴极H+放电,使c(OH-)增大,OH-与HCO3-反应生成CO32-) CO2(g)+3H2(g)= CH3OH(g)+H2O(g) △H=-50kJ/mol
CO32-+H+,阴极H+放电,c(H+)减少平衡右移CO32-再生(或阴极H+放电,使c(OH-)增大,OH-与HCO3-反应生成CO32-) CO2(g)+3H2(g)= CH3OH(g)+H2O(g) △H=-50kJ/mol
【解析】
根据键能计算反应热;根据三段式计算平衡常数、化学平衡原理判断平衡移动方向;根据电解池原理书写电极反应式;根据盖斯定律计算并书写热化学方程式。
(1)反应热等于反应物中键能总和减去生成物中键能总和:即△H=946kJ/mol+436kJ/mol×3-391kJ/mol×6=-92kJ/mol;
(2)用三段式法对数据进行处理得:
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
起始(mol) 0.6 0.5 0
反应(mol)0.6×1/6=0.1 0.3 0.2
平衡(mol) 0.5 0.2 0.2
①该温度时容器中平衡体系的平衡常数K=![]() ;
;
②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,氖气不参加反应,容器体积增大,反应物和生成物浓度减小,相当于减小压强,根据勒夏特列原理平衡向体积增大的方向移动,即平衡将逆向移动;
(3)a.平衡常数只和温度有关,所以T1温度时,B、C两点的平衡常数相等,故a错误;
b.由图所示压强相等时,A点 N2的体积分数大于B点,由于该反应的H<0,说明T2>T1,A点气体总物质的量和温度都比B点高,说明A点时容器内气体的总体积大于B点,气体的总质量保持不变,则A点和B点混合气体的密度大小关系:A<B,故b正确;
c.如图所示,A点 N2的体积分数大于C点,说明A点处容器中气体总物质的量大于C点,气体的总质量保持不变,则混合气体的平均相对分子质量大小关系:C>A,故c错误,故此题选b;
(4)①如图所示,右侧为阳极,阳极发生氧化反应,元素化合价升高,则阳极区发生的反应为:4OH--4e-=O2↑ +2H2O;
②如图所示,CO32-在阴极区再生的原理为溶液中HCO3-存在电离平衡:HCO3-![]() CO32-+H+,阴极H+放电,c(H+)减少平衡右移CO32-再生(或阴极H+放电,使c(OH-)增大,OH-与HCO3-反应生成CO32-);
CO32-+H+,阴极H+放电,c(H+)减少平衡右移CO32-再生(或阴极H+放电,使c(OH-)增大,OH-与HCO3-反应生成CO32-);
③由题干知:I 2H2(g)+O2(g)=2H2O(g) ΔH1=—484kJ/mol,
II 2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(g) ΔH2=—1352kJ/mol;
根据盖斯定律,反应(I×3-II)/2得:CO2(g)+3H2(g)= CH3OH(g)+H2O(g)△H=(—484kJ/mol×3+1352kJ/mol)/2=-50kJ/mol,故CO2和H2生成1molCH3OH(g)的热化学方程式为: CO2(g)+3H2(g)= CH3OH(g)+H2O(g) △H=-50kJ/mol。