题目内容
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经6min后测得D的浓度为0.75mol/L,c(A):c(B)=3:5,以C表示的平均反应速率v(C)=0.125mol/(L·min),下列说法正确的是
A.以B表示的平均反应速率为v(B)=0.03125mol/(L·min)
B.6min时,转化了的A占起始A的50%
C.该反应方程式中,x=3
D.6min时,A的物质的量为0.75mol
【答案】B
【解析】
设A、B的物质的量分别为nmol,6min后C的浓度为0.125 mol·L-1·min-1×6min=0.75mol/L,则6min后n(C)=0.75mol/L×2L=1.5mol,n(D)=0.75mol/L×2L=1.5mol,列“三段式”:

则(n-2.25):(n-0.75)=3:5,n=4.5,0.75x=1.5,解得x=2,据此分析解答。
A.反应速率之比等于计量系数比,以B表示的平均反应速率为v(B)=![]() v(C)=
v(C)=![]() ×0.125mol/(L·min)=0.0625mol/(L·min),故A错误;
×0.125mol/(L·min)=0.0625mol/(L·min),故A错误;
B.6min时,A的转化率=![]() ×100%=50%,故B正确;
×100%=50%,故B正确;
C.根据分析,该反应方程式中,x=2,故C错误;
D.6min时,A的物质的量为4.5mol-2.25mol=2.25mol,故D错误;
答案选B。

【题目】下表是A、B、C、D四种有机物的有关信息:
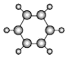
A | ①能使溴的四氯化碳溶液褪色;②比例模型为: |
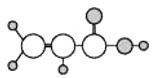
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的官能团名称为________。写出A在一定条件下反应生成高分子化合物的方程式:___________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________________时,这类有机物开始出现同分异构体。
(3)关于B的说法正确的是:___________________。
a、所有原子在同一个平面上 b、六个碳原子之间是单双建交替的结构
c、一个B分子含有6个σ键 d、含有苯环的化合物成为芳香化合物
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为___________________;其化学方程式为___________________。
【题目】我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)![]() 2NH3(g) △H=________kJ/mol
2NH3(g) △H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N2 0.6mol,H2 0.5mol,在一定温度下进行反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。
①该温度时容器中平衡体系的平衡常数是________。
②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,则平衡将____(填“正向”,“逆向”或“不”)移动。
(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)![]() 2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
2NH3(g),平衡后改变容器体积,容器内 N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。
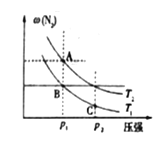
a.A、B、C三点的平衡常数大小关系:KA<KB<KC
b.A点和B点混合气体的密度大小关系:A<B
c.A点和C点混合气体的平均相对分子质量大小关系:A>C
(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图所示:
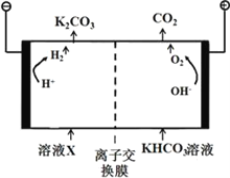
①在阳极区发生的反应包括____________________和H++ HCO3-=H2O+CO2↑。
②简述CO32-在阴极区再生的原理___________________________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,
工业上利用该反应合成甲醇。已知:25℃,101KPa下:
2H2(g)+O2(g)=2H2O(g) ΔH1=—484kJ/mol
2CH3OH(g)+3O2(g)=2CO2 (g)+4H2O(g) ΔH2=—1352kJ/mol
写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________。