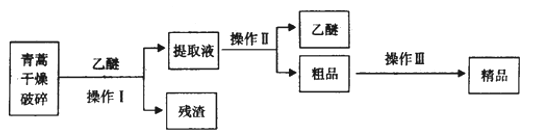
题目内容
【题目】将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另一种气体A,则产生白色沉淀。制备气体A的试剂不能是

A. 大理石和稀盐酸
B. NaOH和NH4Cl
C. Cu和浓硝酸
D. MnO2和浓盐酸
【答案】A
【解析】
由强酸制弱酸的原理可知,SO2与BaCl2溶液不反应,不可能生成BaSO3沉淀,通入另一种气体产生白色沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,否则不生成沉淀。
A项、大理石和稀盐酸制得二氧化碳气体,二氧化碳和二氧化硫与氯化钡均不反应,不会产生沉淀物,故A正确;
B项、NaOH和NH4Cl共热反应生成氨气,通入氨气溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故B错误;
C项、Cu和浓硝酸生成二氧化氮气体,NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故C错误;
D项、MnO2和浓盐酸共热反应生成氯气,Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故D错误。
故选A。

练习册系列答案
相关题目