题目内容
NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA |
| B.标准状况下,22.4L水中含有NA个O—H键 |
| C.足量铜与1L18mol·L-1浓硫酸反应可以生成SO2分子总数为9NA |
| D.100mL0.1mol·L-1HNO3溶液中含有0.01NA个NO3- |
D
解析试题分析:标准状况下,气体摩尔体积为22.4mol·L-1,气体物质的量为1mol,1mol任何气体在标准状况下分子数均是NA,和气体的种类无关,所以22.4L任意比的氢气与氧气的混合气体中的分子总数均为NA,A选项不正确,标况下,水是液态不是气体,故其物质的量远远大于1mol,B选项不正确,过量的铜与浓硫酸反应,随着反应进行浓度变稀,稀硫酸与铜不反应,可产生SO2气体分子小于9NA个,C选项不正确,0.1L×0.1mol·L-1=0.01mol,0.01molHNO3溶液中含有0.01NA个NO3-,D选项正确。
考点:考查阿伏加德罗常数。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
| A.ω=35a/(22.4Vρ) |
| B.c =a/(22.4V)mol/L |
| C.上述氨水中再加入等体积等浓度的稀盐酸后溶液恰好呈中性 |
| D.上述氨水中再加入V mL水后,所得溶液的质量分数小于0.5ω |
下列叙述正确的是
| A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.5.6g铁和6.4g铜分别与0.1mol氯气完全反应,转移的电子数相等 |
| B.0.5molO3与11.2LO2所含的分子数一定相等 |
| C.等质量的 14NO和 13CO气体中含有的中子数相等 |
| D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,1 NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl-个数为1 NA |
下列有关气体的叙述中,错误的是( )
| A.不同的气体,若体积不同,则它们所含的分子数肯定不同 |
| B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1 |
| C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离 |
| D.气态物质没有固定的形状,且容易被压缩 |
工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理为NOx + NH3→N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
| A.1:1 | B.1:3 | C.3:1 | D.2:1 |
下列表达式错误的是
A.碳-12原子表示为 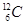 |
B.氮原子的L层电子的电子排布图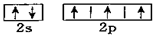 |
| C.硫离子的核外电子排布式1s22s22p63s23p6 |
D.NH4Cl的电子式为: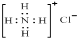 |