题目内容
下列叙述正确的是
| A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA |
A
解析试题分析:A、根据石墨的结构利用分摊法分析知,一个六元环中平均含有2个碳原子,12g石墨烯(单层石墨)中含有六元环的个数为0.5NA,正确;B、25℃时pH=13的NaOH溶液,缺少溶液的体积,无法计算OH一的数目,错误;C、1mol的羟基所含电子数为9 NA,而1 mol的氢氧根离子所含电子数为10 NA,错误;D、忽略了溶剂水中也含有氧原子,1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数远大于3NA,错误。
考点:考查阿伏加德罗常数。

练习册系列答案
相关题目
下列有关表述正确的是
(1)—OH与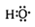 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)HCN分子的结构式:H-C≡N
(3)Br-的离子结构示意图: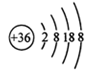
(4)CO2分子的分子模型示意图:
(5)丙烷分子的球棍模型: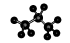
(6)次氯酸的电子式为: 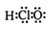
(7)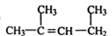 的名称为:1,3-二甲基-2-丁烯
的名称为:1,3-二甲基-2-丁烯
熔化时的电离方程式:NaHSO4为:NaHSO4 Na++HSO4-
Na++HSO4-
| A.(1)(2)(4)(6) | B.(1)(2)(5)(8) |
| C.(1)(4)(5)(8) | D.(2)(3)(5)(7) |
下列物质的化学用语正确的是
①NH4H的电子式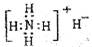
②硝基苯的结构简式: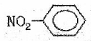
③葡萄糖的实验式:CH2O
④甲烷分子的比例模型: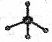
⑤Fe2+的离子结构: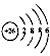
⑥原子核内有10个中子的氧原子: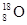
⑦sp2杂化轨道模型: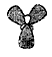
| A.②③⑤ | B.①③⑤⑥ | C.③⑥⑦ | D.②③⑥⑦ |
设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |
5g的钠、镁、铝、铁分别与1mol/L的盐酸100mL反应,产生气体的体积:
| A.铝最多 | B.钠最多 | C.一样多 | D.无法判断 |
下列关于CO的叙述正确的是( )
| A.CO的摩尔质量是28g |
| B.1mol CO中所含分子数为6.02×1023个 |
| C.1 mol CO的质量是28 g / mol |
| D.常温常压下,1 mol CO的体积为22.4 L |
用NA表示阿伏加德罗常数的值,下列说法中不正确的是
| A.1L 0.01mol/L的氯水中含有的分子总数大大超过0.01 NA |
| B.92gNO2和N2O4混合气体中含有的氧原子总数为4NA |
| C.含NA个氧原子的O2与含NA个氧原子的O3的分子个数之比为3:2 |
| D.5.6g Fe 与足量的Cl2充分反应,转移的电子数目为0.2NA |
NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA |
| B.标准状况下,22.4L水中含有NA个O—H键 |
| C.足量铜与1L18mol·L-1浓硫酸反应可以生成SO2分子总数为9NA |
| D.100mL0.1mol·L-1HNO3溶液中含有0.01NA个NO3- |