题目内容
工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理为NOx + NH3→N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
| A.1:1 | B.1:3 | C.3:1 | D.2:1 |
B
解析试题分析:在同温同压下,相同体积的任何气体含有相同数目的分子。由于该反应是氧化还原反应。所以还要符合电子守恒。因此可得方程式:12NOX+14NH3=13N2+21H2O.12X=21,所以X=1.75.假设NO、NO2的物质的量之比为:m:n,则(m+2n)÷(m+n)=1.75.解得m:n=1:3.所以选项为:B。
考点:考查混合气体的化学式的计算方法和氨气还原法治理氮氧化合物的大气污染方法。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |
NA表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,22.4L任意比的氢气与氧气的混合气体中的分子总数均为2NA |
| B.标准状况下,22.4L水中含有NA个O—H键 |
| C.足量铜与1L18mol·L-1浓硫酸反应可以生成SO2分子总数为9NA |
| D.100mL0.1mol·L-1HNO3溶液中含有0.01NA个NO3- |
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50mL 1mol/L NaCl溶液 | D.25mL 0.5mol/L HCl溶液 |
下列有关化学用语表示正确的是
| A.丙烯的结构简式:C3H6 |
B.氢氧根离子的电子式: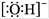 |
C.氯原子的结构示意图: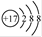 |
| D.中子数为146、质子数为92 的铀(U)原子14692U |
在常温常压下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全反应,最后在相同条件下得到干燥气体450mL,则反应前混合气体中CH4和Ar的物质的量之比为
| A.1:4 | B.1:3 | C.1:2 | D.1:1 |
相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )。
①它们所含的分子数目之比为1∶1
②它们所含的O原子数目之比为1∶2
③它们所含的原子总数目之比为2∶3
④它们所含的C原子数目之比为1∶1
⑤它们的质量之比为7∶11
| A.①④ | B.②③ | C.④⑤ | D.①②③④⑤ |
设NA为阿伏加德罗常数,下列说法正确的是:
| A.1mol铁与1molCl2充分反应,转移电子数为3NA |
| B.常温常压下,22.4L NH3所含的分子数为NA |
| C.常温下,44g CO2中含有2NA个C=O键 |
| D.1mol/L的A1C13溶液中,Al3+离子的数目略小于NA |
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
| A.18 g H2O中含有的质子数为10NA |
| B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA |