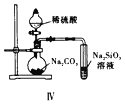
题目内容
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
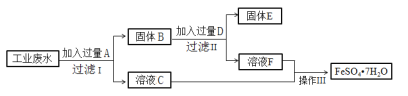
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
【答案】Fe H2SO4 Fe + 2Fe3+=3Fe2+ Fe + Cu2+= Fe2++ Cu 过滤 洗涤
【解析】
工业废水中含大量Fe2+、Fe3+、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,要加入铁粉,可置换出铜,同时生成硫酸亚铁,经过滤,得到的滤液C中主要含硫酸亚铁,滤渣B中含Cu、Fe,向该固体混合物中加入D为H2SO4,得到的溶液F为硫酸亚铁,得到滤渣E为Cu,将溶液C、F合并就是FeSO4溶液,溶液经为蒸发、浓缩、冷却结晶、过滤,洗涤、干燥就可得到FeSO4.7H2O晶体,以此来解答。
工业废水中含大量Fe2+、Fe3+、Cu2+和少量Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,要加入铁粉,可置换出铜,同时生成硫酸亚铁,经过滤,则滤液C中主要含硫酸亚铁,滤渣B中含Cu、Fe,向该固体混合物中加入D为H2SO4,得到的溶液F为硫酸亚铁,得到滤渣E为Cu,将溶液C、F合并就是FeSO4溶液,溶液经为蒸发、浓缩、冷却结晶、过滤,洗涤、干燥就可得到FeSO4.7H2O晶体
(1)加入铁粉,由于金属活动性Fe>Cu,可发生酯化反应,置换出铜,反应的离子方程式为Fe+Cu2+=Fe2++Cu,铁、铜的混合物中加入稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,所以A的化学式为Fe,D的化学式为H2SO4;
(2)由于离子的氧化性Fe3+>Cu2+>Fe2+>Na+,所以向工业废水中加入过量A时,首先发生反应Fe + 2Fe3+=3Fe2+,然后发生反应Fe + Cu2+= Fe2++ Cu;
(3) FeSO4的溶解度受温度的影响变化较大,所以从FeSO4的溶液中获得晶体经过加热,通过蒸发浓缩、冷却结晶,然后过滤、 洗涤,最后干燥,就得到了FeSO47H2O晶体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
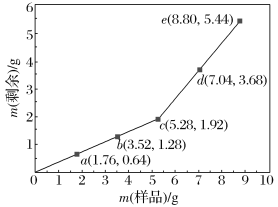
小学生10分钟应用题系列答案【题目】元素X、Y、 Z、W、Q、 M在元素周期表的相对位置如图所示,其中Z元素是目前发现的非金属性最强的元素,下列说法正确的是
X | Y | Z | |
W | Q | M |
A. 对应氢化物的沸点Y> Q是因为Y的非金属性比Q强
B. XM4的比例模型为![]() 其二氢取代物有两种
其二氢取代物有两种
C. W的氧化物,常温下可以和Z、M的氢化物反应
D. Z的单质能将Y的单质从他的氢化物中置换出来
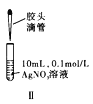
【题目】已知K2Cr2O7溶液中存在平衡:![]() +H2O
+H2O![]() 2
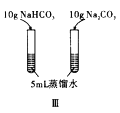
2![]() +2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
5mL0.1mol/LK2Cr2O7溶液 | 序号 | 试剂X |
ⅰ | 1mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是_____(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是_____,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为_____。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了下实验,验证了该反应的发生。
方案:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式______。
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)该温度下,该反应的化学平衡常数K=________________。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________,通过计算说明此时,该反应是否达到了平衡状态__________?