题目内容
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。

①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。

①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
(1)10
(2)O2+4e-+2H2O=4OH-
N2H4+4OH--4e-=4H2O+N2↑
(3)①Cu2++2e-=Cu ②112
(2)O2+4e-+2H2O=4OH-
N2H4+4OH--4e-=4H2O+N2↑
(3)①Cu2++2e-=Cu ②112
(1)据热化学方程式可知,1 mol N2完全反应才能得到92.2 kJ的热量,而N2
转化率为10%,则实际需要投入10 mol N2才能转化1 mol N2。
(2)肼-空气燃料电池中,O2在正极放电,生成OH-。
(3)电解池中,Cu做阳极,自身放电生成Cu2+,由电子守恒得Cu~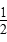 O2~2e-,n(Cu)
O2~2e-,n(Cu)
=2 mol,消耗n(O2)=1 mol,则V空气=112 L(标准状况)。
转化率为10%,则实际需要投入10 mol N2才能转化1 mol N2。
(2)肼-空气燃料电池中,O2在正极放电,生成OH-。
(3)电解池中,Cu做阳极,自身放电生成Cu2+,由电子守恒得Cu~
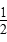 O2~2e-,n(Cu)
O2~2e-,n(Cu)=2 mol,消耗n(O2)=1 mol,则V空气=112 L(标准状况)。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1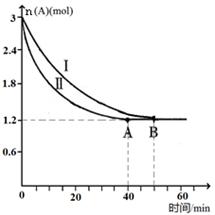
 CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
 CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。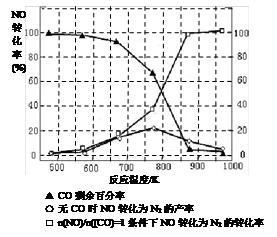
 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0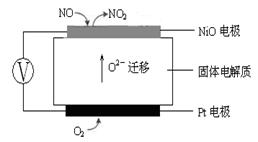

 2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断:
2CO2+N2。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如下图所示。据此判断: 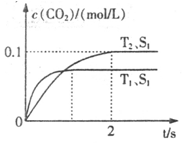
 N2O4 (g) △H=-56.9kJ ? mol-1
N2O4 (g) △H=-56.9kJ ? mol-1 CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g) + H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如右图t2后所示的变化,则改变的条件可能是 (填符号)。


 ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“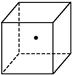
 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。