题目内容
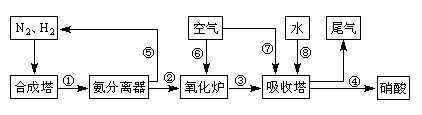
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
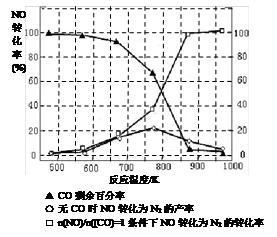
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。(2)合成塔中发生反应N2(g)+3H2(g)
 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。

(1)(2分)1 (2)(2分)<
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- =N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- =N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
试题分析:(1)根据“三段式”进行计算:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)初始浓度(mol?L?1) 0.2 0.3 0 0
转化浓度(mol?L?1) 0.12 0.12 0.12 0.12
平衡浓度(mol?L?1) 0.08 0.18 0.12 0.12
平衡常数K=0.12×0.12÷(0.08×0.18)=1。
(2)因为该反应△H<0,为放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小,T1的平衡常数大于300℃时平衡常数,所以T1 < 300℃。
(3)燃料电池中,O2为正极,燃料为负极,所以通入氨气的电极是负极;NH3失去电子生成的单质为N2,所以电极方程式为:2NH3 — 6e- + 6OH- =N2 +6H2O
(4)NO2被还原为N2,则CH4被氧化为CO2,写出化学方程式并配平,CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),根据盖斯定律求出焓变,△H=1/2△H1+1/2△H2=-867kJ?mol?1,可得热化学方程式。
(5)0~775K,为反应建立化学平衡的过程,775K时达到平衡,温度继续升高,NO的转化率减小,说明正反应为放热反应,温度升高,平衡向逆反应方向移动。

练习册系列答案
相关题目


 CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
 CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
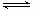 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
 CO2(g)+2H2O(l) ΔH1=-Q1
CO2(g)+2H2O(l) ΔH1=-Q1 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1 CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:

