题目内容
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
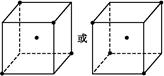
(2)如图立方体中心的“ ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“ ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。

(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)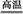 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
(2)如图立方体中心的“
 ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“ ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
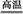 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。 (1)> <
(2)
(3)+236
(2)

(3)+236
(1)物质熔化时需断键,断键需吸收能量,而键能越大的物质,断键所吸收能量越大,熔点越高。所以熔点:SiC>Si;SiCl4<SiO2。
(2)相邻的四个硅原子形成正四面体结构。
(3)1 mol硅中含2 mol Si—Si键,再根据:ΔH=反应物的键能-生成物的键能,得ΔH="4E(Si—Cl)+2E(H—H)-2E(Si—Si)-4E(H—Cl)=4×360" kJ/mol+2×436 kJ/mol-2×176 kJ/mol-4×431 kJ/mol="+236" kJ/mol。
(2)相邻的四个硅原子形成正四面体结构。
(3)1 mol硅中含2 mol Si—Si键,再根据:ΔH=反应物的键能-生成物的键能,得ΔH="4E(Si—Cl)+2E(H—H)-2E(Si—Si)-4E(H—Cl)=4×360" kJ/mol+2×436 kJ/mol-2×176 kJ/mol-4×431 kJ/mol="+236" kJ/mol。

练习册系列答案
相关题目
 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为: O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1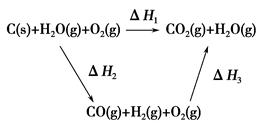
 N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。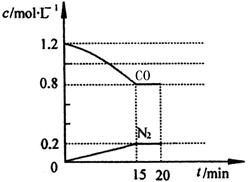
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
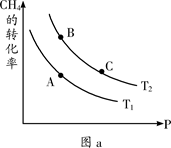
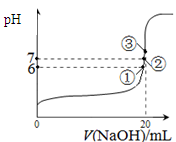
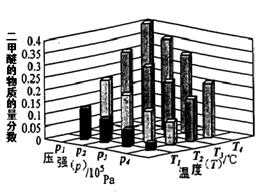
H2(g)+CO2(g) ΔH=-41kJ·mol-1 CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图: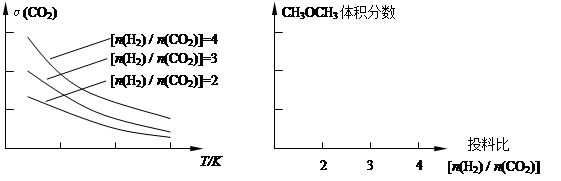

 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。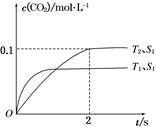
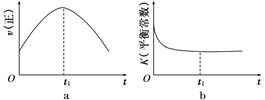
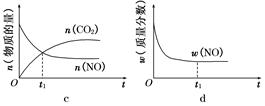

 CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1 CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0