题目内容
【题目】A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出)
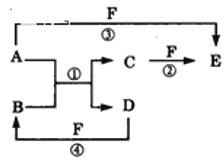
(1)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,反应④的离子方程式是__,用电子式表示C的形成过程__,六种物质中所有元素的原子半径由大到小的顺序为__(用元素符号表示)。
(2)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则C的化学式为__,E的结构式为__,A、D、F所对应元素的气态氢化物的稳定性,由强到弱的顺序是__(用化学式表示),反应①的化学方程式是__。
(3)若B、C、F都是气态单质,且B为黄绿色,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,反应①的化学方程式是__,在反应中若有3mol电子转移,则生成C的物质的量为___。
【答案】C+4H++4NO3![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O ![]() Mg>C>N>O>H CO O=C=O H2O>CH4>SiH4 SiO2+2C
Mg>C>N>O>H CO O=C=O H2O>CH4>SiH4 SiO2+2C![]() Si+2CO↑ 2NH3+3Cl2=N2+6HCl 0.5mol
Si+2CO↑ 2NH3+3Cl2=N2+6HCl 0.5mol
【解析】
(1)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,则D处于第二周期、A处于第三周期,设A原子最外层电子数为x,则2+8+x=2(2+2x),解得x=2,故A为Mg,D为C,则B为CO2,C为MgO,③与④两个反应中都有红棕色气体生成,则F为HNO3,E为Mg(NO3)2,据此分析解答;
(2)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,D为Si,F为O,B为SiO2,据此分析解答;
(3)若B、C、F都是气态单质,且B为黄绿色,则B为Cl2,反应②需要放电条件才能发生,为氮气与氧气反应,③和④两个反应中都有水生成,可以推知C为N2,F为O2,E为NO,A为NH3,反应①为置换反应,A、D相遇有白烟生成,可推知D为HCl,据此分析解答。
(1)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,则D处于第二周期、A处于第三周期,设A原子最外层电子数为x,则2+8+x=2(2+2x),解得x=2,故A为Mg,D为C,则B为CO2,C为MgO,③与④两个反应中都有红棕色气体生成,则F为HNO3,E为Mg(NO3)2,反应④的离子方程式是C+4H++4NO3![]() CO2↑+4NO2↑+2H2O;C为MgO,C的形成过程为:
CO2↑+4NO2↑+2H2O;C为MgO,C的形成过程为:![]() ;六种物质中所有元素为H、Mg、N、C、O,同周期元素,随核电荷数增大,半径减小,原子半径由大到小的顺序为Mg>C>N>O>H;
;六种物质中所有元素为H、Mg、N、C、O,同周期元素,随核电荷数增大,半径减小,原子半径由大到小的顺序为Mg>C>N>O>H;
(2)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则A为C,D为Si,F为O,B为SiO2,A和F反应生成E,C和F生成E,则C的化学式为CO,E为CO2,结构式为O=C=O;A、D、F所对应元素的气态氢化物分别为H2O、CH4、SiH4,非金属性越强,对应气态氢化物的稳定性越强,则由强到弱的顺序是H2O>CH4>SiH4;反应①为化学方程式是SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)若B、C、F都是气态单质,且B为黄绿色,则B为Cl2,反应②需要放电条件才能发生,为氮气与氧气反应,③和④两个反应中都有水生成,可以推知C为N2,F为O2,E为NO,A为NH3,反应①为置换反应,A、D相遇有白生成,可推知D为HCl,反应①为置换反应,化学方程式是2NH3+3Cl2=N2+6HCl,每生成1mol N2转移6mol电子,则若有3mol电子转移,生成N2的物质的量为0.5mol。

【题目】A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 其一种单质可吸收紫外线,是地球的保护伞 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1)B元素符号为___,G的元素名称为___,它的一种同位素可测定文物年代,这种同位素的符号是___。
(2)A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为___(填“离子化合物”或“共价化合物”),包含的化学键有__(填“离子键”、“极性共价键”或“非极性共价键”)。
(3)F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为__和__,并用电子式表示出其最简单气态氢化物的形成过程___。
(4)D在元素周期表中的位置__,D与E相比非金属性较强的是__(填元素名称),请从原子结构的角度解释原因:__。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
【题目】某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。经查阅资料可知浓硝酸分解产生NO2和O2。为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用如图装置完成以下实验:
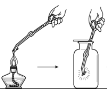
序号 | 实验I | 实验II |
集气瓶中所盛气体 | O2 | 加热浓硝酸 产生的气体 |
现象 | 木炭迅速燃烧发出亮光 | 木炭迅速燃烧发出亮光 |
下列说法正确的是
A. 浓硝酸分解产生的V(NO2):V(O2)=1:1
B. 红棕色气体的产生表明木炭与浓硝酸发生了反应
C. 能使液面上木炭迅速燃烧发出亮光的主要气体是氧气
D. 以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO2