题目内容
【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(![]() ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:

在如图圆底烧瓶中加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,小心加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
![]()
(1)加入碎瓷片的作用是______,加入浓硫酸的作用是_____;
(2)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学反应方程式:_______;
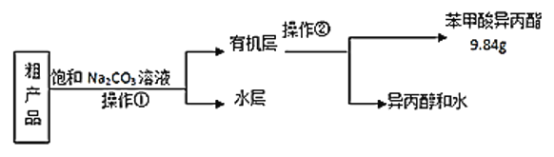
(3)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_________;操作②的名称是__________。
(4)在进行操作②收集苯甲酸异丙酯时应控制的温度范围_______。
A.80℃~100℃ B.200℃~249℃ C.217℃~219℃ D.249℃以上
【答案】防止暴沸 催化剂和吸水剂 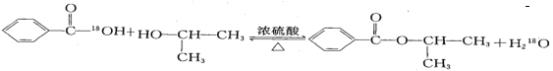 分液漏斗 蒸馏 C
分液漏斗 蒸馏 C
【解析】
(1)混合液体加热为防止液体暴沸,需要加入碎瓷片;浓硫酸在反应中的作用是催化剂和吸水剂;
(2)酯化反应机理为酸脱羟基醇脱氢,羟基与氢原子结合形成水,据此写出该反应的化学方程式;
(3)分液用于分离两种不互溶的液体,蒸馏用于互溶但沸点相差较大的两种(或两种以上)液体分离,根据物质性质的不同选择合适的仪器;
(4)根据苯甲酸异丙酯的沸点选择合适的温度范围。
(1)液体混合物加热时为防止液体暴沸,需要加入碎瓷片,因此加入碎瓷片的目的是防止暴沸;苯甲酸与异丙醇在浓硫酸存在时加热发生酯化反应,产生苯甲酸异丙酯和水,浓硫酸的作用是催化剂,同时反应产生的水被浓硫酸吸收,可以使酯化反应正向进行,促使酯化反应的进行;
(2)苯甲酸与异丙醇在浓硫酸作用下的酯化反应实质为:苯甲酸脱去羟基,异丙醇脱去羟基的H原子,所以水中18O原子来自苯甲酸,则反应的化学方程式为: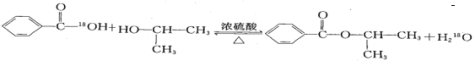 ;
;
(3)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等物质,苯甲酸异丙酯是不溶于水的液体,异丙醇、水能溶于饱和碳酸钠溶液,苯甲酸和碳酸钠发生反应,进入溶液,所以操作Ⅰ是分离互不相溶的液体混合物的方法,采用分液法分离,分液使用的主要玻璃仪器为分液漏斗;根据互溶的液体混合物中物质沸点的不同,采用蒸馏的方法分离。
(4)若要收集苯甲酸异丙酯,可根据苯甲酸异丙酯的沸点是218℃,收集217℃~219℃的馏分即可,故合适选项是C。

【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
【题目】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1) A元素在元素周期表中的位置________;A、B、C三种元素的第一电离能由大到小的排序为_____(用元素符号填写);
(2) B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为____,B元素所形成的单质分子中σ键与π键数目之比为____。
(3) G元素的低价阳离子的离子结构示意图是________,F元素原子的外围电子排布图是________,H元素的基态原子核外电子排布式是________。
(4) D元素的单质及其常见化合物的焰色反应主要利用了原子光谱中的______(A.原子吸收光谱B.原子发射光谱)
(5) 上述元素属于p区的是_______(用元素符号填写);