题目内容
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
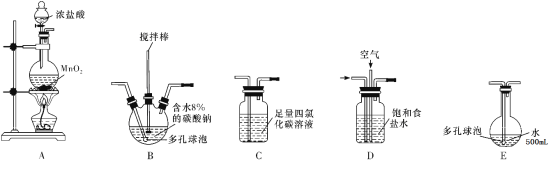
回答下列问题:
(1)各装置的连接顺序为______→_____→_____→____→E。
(2)装置A中反应的离子方程式是______。
(3)装置E中反应的化学方程式是_____。
(4)装置B中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置C的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
【答案】A D B C MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Cl2O+H2O=2HClO 加快反应速率,使反应充分进行 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl离子或氯元素的利用率高等
Mn2++Cl2↑+2H2O Cl2O+H2O=2HClO 加快反应速率,使反应充分进行 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl离子或氯元素的利用率高等
【解析】
A装置用二氧化锰和浓盐酸制备氯气,由D装置饱和食盐水吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,通入C装置吸收除去Cl2O中的Cl2,并在E装置中用水吸收Cl2O制备次氯酸溶液,据此分析作答。
(1)A装置制备氯气,D装置吸收吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,与含水8%的碳酸钠充分反应制备Cl2O,C装置吸收除去Cl2O中的Cl2,E装置中用水吸收Cl2O制备次氯酸溶液,所以各装置的连接顺序为A→D→B→C→E;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)E装置中用水吸收Cl2O制备次氯酸溶液,反应的方程式为:Cl2O+H2O ![]() 2HClO;
2HClO;
(4)装置B中多孔球泡增大接触面积、搅拌棒的作用增加接触机会,两者的作用是加快反应速率,使反应充分进行;由题可知:Cl2O 42℃以上会分解生成Cl2和O2,故为防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中;
(5)Cl2O为极性分子,Cl2为非极性分子,根据相似相容原理,氯气易溶于四氯化碳,可在装置C中除去Cl2O中的Cl2;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是:制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl-离子或氯元素的利用率高等。