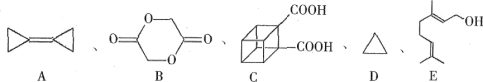
题目内容
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W和X的最高价氧化物的水化物之间可以相互反应生盐和水,该反应的离子方程式为___。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___。
(3)比较Y、Z气态氢化物的稳定性 > (用化学式表示)___。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___。
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > (用离子符号表示)___。
【答案】Al(OH)3+OH-=AlO2-+2H2O ![]() HCl>H2S SO2+Cl2+2H2O=H2SO4+2HCl S2->Cl->Na+>Al3+
HCl>H2S SO2+Cl2+2H2O=H2SO4+2HCl S2->Cl->Na+>Al3+
【解析】
(1)W、X的最高价氧化物对应的水化物可以反应,由于W、X是金属元素,说明他们的最高价氧化物对应水化物的反应是氢氧化物之间的反应,所以W是Na,X是Al;
(2)Na与Y可形成化合物Na2Y,说明Y是S元素;
(3)Z是Cl元素,非金属性Cl>S;
(4)将二氧化硫通入氯水中发生氧化还原反应生成硫酸和氯化氢,据此书写反应的化学方程式;
(5)简单离子的离子半径,电子层数越多,半径越大,层数相同时,核电荷越多半径越小。
(1)W、X的最高价氧化物对应的水化物可以反应,由于W、X是金属元素,说明他们的最高价氧化物对应水化物的反应是氢氧化物之间的反应,所以W是Na,X是Al,氢氧化钠和氢氧化铝反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)Na与Y可形成化合物Na2Y,说明Y是S元素,硫化钠的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Z是Cl元素,非金属性Cl>S,所以气态氢化物的稳定性HCl>H2S,故答案为:HCl>H2S;
(4)将二氧化硫通入氯水中发生氧化还原反应生成硫酸和氯化氢,反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl,故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(5)简单离子的离子半径,电子层数越多,半径越大,层数相同时,核电荷越多半径越小,Na、Al、S、Cl元素的简单离子的半径由大到小的顺序为:S2->Cl->Na+>Al3+,故答案为:S2->Cl->Na+>Al3+。

【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
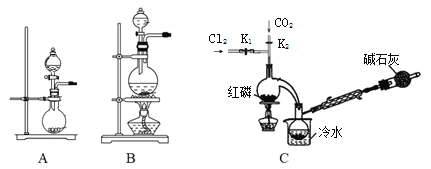
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
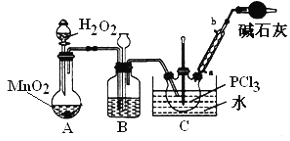
资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。