题目内容
10.2011年4月台湾曝出的增塑剂风波一度让人们“谈塑色变”.常用的增塑剂如下: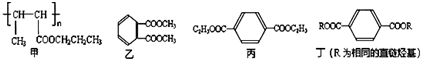
请回答下列问题:
(1)下列对甲的叙述正确的是B(填选项字母)
A.甲能使Br2的CCl4溶液褪色
B.甲的单体是CH3CH=CHCOOCH2CH2CH3
C.1mol甲能与1mol NaOH发生水解反应
D.甲能发生酯化反应、取代反应、消去反应、加成反应
(2)丙中含有的官能团名称是酯基.
(3)乙的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式
 ).
).(4)已知通过燃烧法确定丁的含氧量(质量分数)为23%.以某烃A为原料合成该塑料增塑剂的流程如下:

①反应1的反应条件是NaOH水溶液、加热.
②反应2的反应类型是氧化反应.
③反应3的化学方程式是
 .
.
分析 (1)根据甲的结构简式可知,甲中有酯基,根据酯的性质答题;
(2)根据丙的结构简式判断丙中官能团;
(3)根据乙的结构简式和条件:不含甲基的羧酸,书写结构简式;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为对苯二甲酸丁酯,由合成路线可知,D为 .A与氯气在光照的条件下发生取代反应生成
.A与氯气在光照的条件下发生取代反应生成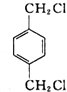 ,故A为
,故A为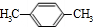 ,
, 在NaOH水溶液条件下生成水解反应生成B,B为
在NaOH水溶液条件下生成水解反应生成B,B为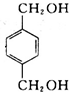 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为 ,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,据此解答.
,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,据此解答.
解答 解:(1)根据甲的结构简式可知,甲中有酯基,所以甲不能使Br2的CCl4溶液褪色,根据甲的结构简式可知甲的单体是CH3CH=CHCOOCH2CH2CH3,1mol甲能与nmol NaOH发生水解反应,甲不能发生酯化反应、消去反应、加成反应,故选B;
(2)根据丙的结构简式可知,丙中官能团为酯基,
故答案为:酯基;
(3)属于不含甲基的羧酸,且是乙的同分异构体的结构简式为 ,
,
故答案为: ;
;
(4)丁的含氧量(质量分数)为23%,丁分子中有四个氧原子,所以丁的相对分子质量为$\frac{64}{23%}$=278,所以丁中每个烃基的相对分子质量为57,R为直链烃基,所以烃基为-CH2CH2CH2CH3,丁为对苯二甲酸丁酯,由合成路线可知,D为 .A与氯气在光照的条件下发生取代反应生成
.A与氯气在光照的条件下发生取代反应生成 ,故A为
,故A为 ,
, 在NaOH水溶液、加热的条件下生成水解反应生成B,B为
在NaOH水溶液、加热的条件下生成水解反应生成B,B为 ,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为
,B在金属铜或银作催化剂、加热条件下,被氧气氧化性生成C为 ,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,
,进一步发生氧化反应生成D,D发生酯化反应生成对苯二甲酸丁酯,
①根据上面的分析可知,反应1的反应条件是NaOH水溶液、加热,
故答案为:NaOH水溶液、加热;
②根据上面的分析可知,反应2的反应类型是氧化反应,
故答案为:氧化反应;
③反应3的化学方程式是 ,
,
故答案为: .
.
点评 本题考查有机物的推断,丁的推断是解答的关键,注意利用转化关系中的反应条件及碳链变化推断各有机物即可解答,注意把握有机物结构与性质的关系,题目难度中等

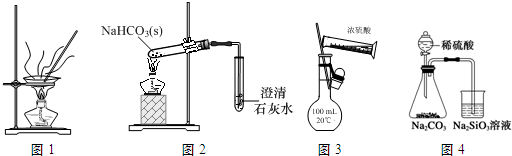
| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
| A. | 0.1molFe在0.1mol氯气中充分燃烧时转移的电子数为0.3NA | |
| B. | 0.1mol乙烷和丙烯的混合物所含氢原子数目为0.6NA | |
| C. | 64g的SO2与足量的O2充分反应后可得到NA个S03分子 | |
| D. | 标准状况下,2.24L HF含有的分子数目为0.1NA |
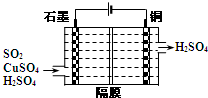 二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料. 铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用. (1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
(1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2