题目内容
20.NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 0.1molFe在0.1mol氯气中充分燃烧时转移的电子数为0.3NA | |
| B. | 0.1mol乙烷和丙烯的混合物所含氢原子数目为0.6NA | |
| C. | 64g的SO2与足量的O2充分反应后可得到NA个S03分子 | |
| D. | 标准状况下,2.24L HF含有的分子数目为0.1NA |
分析 A、铁和氯气反应生成氯化铁,依据全部反应的物质计算电子转移;
B、乙烷和丙烯中均含6个氢原子;
C、二氧化硫与氧气的反应为可逆反应;
D、标况下,HF为液态.
解答 解:A、0.1molFe和0.1molCl2中充分燃烧,2Fe+3Cl2=2FeCl3,铁过量,依据0.1mol氯气反应得到电子0.2mol,转移电子数为0.2NA,故A错误;
B、乙烷和丙烯中均含6个氢原子,故0.1mol乙烷和丙烯的混合物中含0.6mol氢原子即0.6NA个,故B正确;
C、二氧化硫与氧气的反应为可逆反应,不能进行彻底,故得到的三氧化硫分子个数小于NA个,故C错误;
D、标况下,HF为液态,其分子个数不能根据其体积来计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
11.如图为KNO3、NaCl的溶解度曲线图,下列有关说法正确的是( )


| A. | 温度相同(>t1℃)时,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数 | |
| B. | t1℃时,KNO3、NaCl饱和溶液中溶质的物质的量浓度相等 | |
| C. | 用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体 | |
| D. | 将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g |
8.下列物质①C2H6 ②C3H6 ③C6H14 ④C5H8充分燃烧,等质量时产生CO2最多的、消耗O2最多的;等物质的量时消耗O2最多的、生成水最多的依次是( )
| A. | ④①③① | B. | ④①③③ | C. | ④③④③ | D. | ①②④③ |
15.在NaHSO4溶液中离子的总浓度为0.06mol/L,若加入等体积离子浓度为0.06mol/L的Ba(OH)2溶液,混合后溶液的体积不变,则溶液的pH值为( )
| A. | 2 | B. | 1.7 | C. | 12 | D. | 12.3 |
5.下列离子在溶液中可以大量共存的一组是(
| A. | H+、Na+、SiO${\;}_{3}^{2}$、NO${\;}_{3}^{-}$ | B. | Ag+、Fe3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | ||
| C. | H+、Cu2+、Cl-、NO3- | D. | NH${\;}_{4}^{+}$、H+、SO${\;}_{4}^{2-}$、HCO3- |
9.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去0.3NA个电子 | |
| B. | 20g重水(2H2O)含有10NA个电子 | |
| C. | 0.1mol/L的氯化铝溶液500mL,氯离子的物质的量浓度为0.15 mol/L | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
10.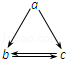 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al2O3 | AlCl3 | Al(OH)3 |
| B | FeO | FeCl2 | Fe(OH)3 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
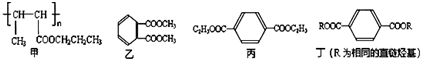
 ).
).
 .
.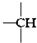 、
、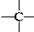 ,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论: