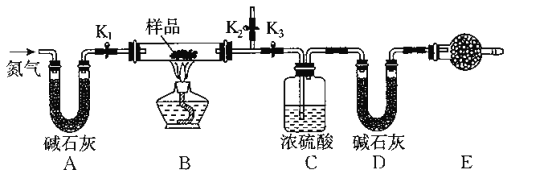
题目内容
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
【答案】A
【解析】
A.Mg(HCO3)2溶液与足量NaOH溶液反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO![]() +4OH-===Mg(OH)2↓+2H2O+2
+4OH-===Mg(OH)2↓+2H2O+2![]() ,故A正确;
,故A正确;
B. 过量SO2通入到NaClO溶液中,正确的离子方程式为:2 SO2+2H2O+ClO-=H2SO3+SO42-+2 H++ Cl﹣,故B错误;
C.NH3·H2O为弱电解质,Al2(SO4)3溶液中加入过量NH3·H2O反应生成氢氧化铝沉淀,正确的离子反应为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故C错误;
D. 次氯酸根离子具有强氧化性,能够将氢氧化铁氧化成FeO42-,KClO碱性溶液与Fe(OH)3反应制取K2FeO4,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-,故D错误;
答案选A。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
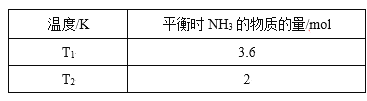
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
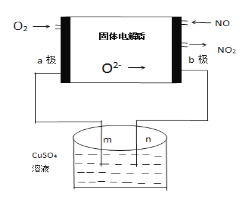
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。