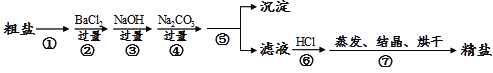
题目内容
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_______。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是____________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
1、本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2、密封保存,请勿与洁厕灵同时使用。
3、保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色
MnCl2+Cl2↑+2H2O 除去氯气中的水蒸气 E中不褪色,F中褪色 干燥的氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性 出现蓝色  Cl+ClO+2H+=Cl2↑+H2O
Cl+ClO+2H+=Cl2↑+H2O ![]() +HClO=
+HClO=![]() +H++Cl
+H++Cl
【解析】
实验室用浓盐酸与二氧化锰加热反应制备氯气,浓盐酸具有挥发性,制备的氯气中含有氯化氢、水,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,依次通过干燥有色布条、湿润有色布条验证氯气是否具有漂白性,再通过G装置验证氯气的氧化性,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气。
(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水;
(2)要验证氯气是否具有漂白性,应让干燥的氯气依次通过干燥有色布条、湿润有色布条;
(3)依据氯气不具有漂白性,具有漂白性的是氯气与水反应生成的次氯酸解答;
(4)依据氯气与碘化钾反应生成单质碘,碘遇到淀粉变蓝解答;
(5)氯气有毒不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收过量的氯气;
(6)次氯酸根离子与氯离子发生氧化还原反应生成氯气和水;
(7)次氯酸具有强氧化性,能够与亚硫酸根离子发生氧化还原反应。
(1)MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)D中浓硫酸作用为干燥氯气,防止水蒸气对氯气漂白性检验造成干扰;
故答案为:除去氯气中的水蒸气;
(3)干燥的氯气依次通过E中红色干布条,F中红色湿布条,看到现象为E中布条不褪色,F中布条褪色,说明氯气不具有漂白性,具有漂白性的为次氯酸;
故答案为:E中布条不褪色,F中布条褪色;氯气不具有漂白性,具有漂白性的为次氯酸;
(4)氯气具有强的氧化性,与碘化钾反应生成单质碘,碘遇到淀粉变蓝,所以看到现象为:棉花团变蓝;
故答案为:出现蓝色;
(5)氯气有毒不能直接排放到空气中,氯气能够与碱反应,可以用氢氧化钠溶液吸收过量的氯气,装置如图所示: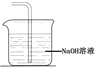 ;
;
故答案为: ;
;
(6)次氯酸根离子与氯离子发生氧化还原反应生成氯气和水,离子方程式:Cl+ClO+2H+=Cl2↑+H2O;
故答案为:Cl+ClO+2H+=Cl2↑+H2O;
(7)亚硫酸根离子与次氯酸反应生成硫酸根离子、氯离子,反应的离子方程式为:![]() +HClO=
+HClO=![]() +H++Cl,
+H++Cl,
故答案为:![]() +HClO=
+HClO=![]() +H++Cl;
+H++Cl;

【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D