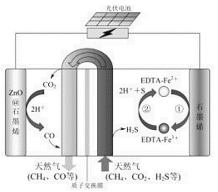
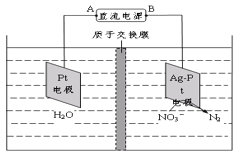
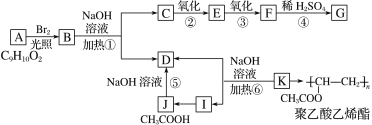
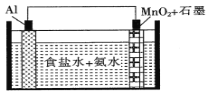
题目内容
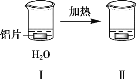
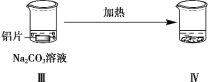
【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
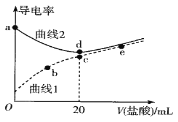
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
【答案】C
【解析】
A.依据铝能与热水反应,实验Ⅰ中没有气泡冒出,说明表面有氧化膜,实验Ⅲ有气泡冒出,说明氧化膜被破坏,故A正确;
B.碳酸根离子为多元弱酸根离子,分步水解,以第一步为主,水解离子方程式:CO32-+H2O![]() HCO3-+OH-,故B正确;
HCO3-+OH-,故B正确;
C.盐类水解为吸热过程,加热促进盐类水解,氢气逸出有利于铝与氢氧根离子的反应,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,消耗氢氧根离子,促进碳酸根离子水解,所以加热和H2逸出对CO32-水解平衡移动都起到促进作用,故C错误;
D.碳酸钠水解显碱性,铝表面的氧化铝与碱反应生成偏铝酸根离子,去掉氧化膜后,铝与氢氧根离子、水反应生成氢气,碳酸根离子部分水解生成碳酸氢根离子,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和二氧化碳,离子方程式:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,故D正确;
故答案为C。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 其一种单质可吸收紫外线,是地球的保护伞 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1)B元素符号为___,G的元素名称为___,它的一种同位素可测定文物年代,这种同位素的符号是___。
(2)A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为___(填“离子化合物”或“共价化合物”),包含的化学键有__(填“离子键”、“极性共价键”或“非极性共价键”)。
(3)F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为__和__,并用电子式表示出其最简单气态氢化物的形成过程___。
(4)D在元素周期表中的位置__,D与E相比非金属性较强的是__(填元素名称),请从原子结构的角度解释原因:__。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。