题目内容
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。下列说法正确的是( )
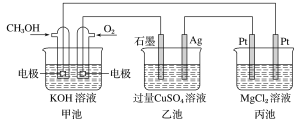
A. 1min内甲池消耗1mol O2转移的电子是乙池Ag电极转移电子数的4倍
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
【答案】D
【解析】
由装置示意图可知,甲池是CH3OH燃料电池,是化学能能转化为电能的装置,乙、丙池是电解池,是将电能能转化为化学能的装置。
A项、1min内甲池消耗1mol O2,反应转移的电子为4mol,甲池和乙池中,转移的电子数目相等,乙池Ag电极为阴极, 转移的也为4mol,析出2molCu,故A错误;
B项、甲池是燃料电池,CH3OH燃料通入的极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以电极反应不会生成氢离子,故B错误;
C项、电解硫酸铜时,阳极放氧气,阴极析出金属铜,所以要让电解质在电解后复原,应加入氧化铜,故C错误;
D项、丙池中电解氯化镁溶液,电解的离子方程式为Mg2++2Cl-+2H2O ![]() H2↑+Cl2↑+Mg(OH)2↓,甲池中标准状况下消耗280mLO2的物质的量为0.0125mol,转移的电子为0.05mol,此时析出氢氧化镁的物质的量为58g/mol×0.025mol=1.45g,故D正确.
H2↑+Cl2↑+Mg(OH)2↓,甲池中标准状况下消耗280mLO2的物质的量为0.0125mol,转移的电子为0.05mol,此时析出氢氧化镁的物质的量为58g/mol×0.025mol=1.45g,故D正确.
故选D。

【题目】探究铝片与Na2CO3溶液的反应,下列说法不正确的是( )
|
| |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
A.对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
B.Na2CO3溶液中存在平衡:CO32-+H2O![]() HCO3- +OH-
HCO3- +OH-
C.加热和H2逸出对CO32-水解平衡移动方向的影响是相反的
D.推测出现白色浑浊的原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率