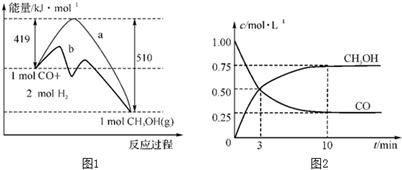
题目内容
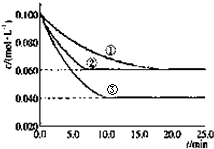 在密闭容器中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L;c(B)=0.200mol/L;c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在密闭容器中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L;c(B)=0.200mol/L;c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )| A、实验②平衡时B的转化率为60% |
| B、反应A(g)+2B(g)?C(g)的△H>0 |
| C、若反应①、②的平衡常数分别为K1、K2,则K1<K2 |
| D、减小反应③的压强,可以使平衡时c(A)=0.060mol/L |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:与①比较,②反应速率增大,但与①处于同一平衡状态,则②应为加入催化剂,与①比较,③反应速率增大,可能是升高温度或增大压强,但如是增大压强,减小容器的体积虽然平衡向正反应方向移动,但A的平衡浓度反而增大,不符合图象,则应为升高温度.
解答:
解:A、反应达到平衡状态时,A反应了(0.100-0.060)mol?L-1=0.040mol/L,设B反应了X.
A+2B?C
1 2
0.040 X
X=0.080mol/L,
B的转化率=
=40%,故A错误;
B、升高温度,平衡向吸热反应方向移动,A的物质的量浓度降低,说明平衡向正反应方向移动,正反应是吸热反应,即△H>0,故B正确;
C、平衡常数只与温度有关,与有无催化剂无关,反应①、②的温度相同,所以平衡常数相同,故C错误;
D、减小反应③的压强,平衡向逆反应方向移动,所以可以使平衡时c(A)=0.060mol?L-1,故D正确;
故选BD.
A+2B?C
1 2
0.040 X
X=0.080mol/L,
B的转化率=
| 0.080mol/L |
| 0.200mol/L |
B、升高温度,平衡向吸热反应方向移动,A的物质的量浓度降低,说明平衡向正反应方向移动,正反应是吸热反应,即△H>0,故B正确;
C、平衡常数只与温度有关,与有无催化剂无关,反应①、②的温度相同,所以平衡常数相同,故C错误;
D、减小反应③的压强,平衡向逆反应方向移动,所以可以使平衡时c(A)=0.060mol?L-1,故D正确;
故选BD.
点评:本题考查化学平衡图象题,题目难度中等,注意分析曲线的变化特点,把握影响化学平衡以及反应速率的因素,注意温度对平衡的影响.

练习册系列答案
相关题目
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是( )
| A、1:2混合的PbO2、Pb3O4 |
| B、1:1混合的Pb3O4、PbO |
| C、1:4:1混合的PbO2、Pb3O4、PbO |
| D、4:1:1混合的PbO2、Pb3O4、PbO |
下列离子方程式正确的是( )
| A、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、Fe3O4溶液稀盐酸:Fe3O4+8H+═3Fe3++4H2O |
| C、用烧碱溶液吸收氯气:Cl2+2OH-═Cl-+ClO-+H2O |
| D、向硫酸亚铁溶液中加入用硫酸酸化的H2O2溶液Fe2++H2O2+2H+═Fe3++4H2O |
下列有机物命名正确的是( )
| A、1,3,4-三甲苯 |
| B、2-甲基丙烷 |
| C、1-甲基-1-丙醇 |
| D、2-甲基-3-丁炔 |
氢叠氮酸(HN3)与醋酸的酸性相近,其盐稳定,但受撞击易发生爆炸生成N2.关于HN3有以下说法:①HN3不能与小苏打水溶液反应生成CO2;②固体HN3熔沸点较高;③固体NaN3属于离子晶体;④NaN3可用于小汽车防撞保护气囊.其中正确的是( )
| A、①② | B、②④ | C、③④ | D、②③ |
下列溶液中各微粒的浓度关系正确的是( )
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
| B、向醋酸钠中加适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、1.0mol/L Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
一定条件下,下列各组物质混合后,两种反应物最有可能恰好反应完的是( )
| A、浓盐酸和MnO2制Cl2 |
| B、铜和浓硫酸 |
| C、铜和浓硝酸 |
| D、大理石块和硫酸 |