题目内容
下列溶液中各微粒的浓度关系正确的是( )
| A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
| B、向醋酸钠中加适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、1.0mol/L Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.硫酸铵中含有2个铵根离子,硫酸氢铵为强酸性溶液,氢离子抑制了铵根离子的水解,氯化铵中铵根离子正常水解,据此判断溶液中铵根离子浓度大小;
B.溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-);
C.根据碳酸钠溶液中的质子守恒进行判断;
D.A2-离子带有2个单位的负电荷,电荷守恒中其系数应该为2.
B.溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-);
C.根据碳酸钠溶液中的质子守恒进行判断;
D.A2-离子带有2个单位的负电荷,电荷守恒中其系数应该为2.
解答:
解:A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中,由于铵根离子只是部分水解,硫酸铵中含有2个铵根离子,则硫酸铵中铵根离子浓度最大,硫酸氢铵为强酸性溶液,氢离子抑制了铵根离子的水解,硫酸氢铵中铵根离子浓度大于氯化铵,则溶液中c(NH4+)大小为:(NH4)2SO4>NH4HSO4>NH4Cl,故A正确;
B.醋酸钠中加适量醋酸,得到的酸性混合溶液,则c(H+)>c(OH-),根据电荷守恒可得:c(Na+)<c(CH3COO-),所以溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.根据1.0mol/L Na2CO3溶液中的质子守恒可知:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选A.
B.醋酸钠中加适量醋酸,得到的酸性混合溶液,则c(H+)>c(OH-),根据电荷守恒可得:c(Na+)<c(CH3COO-),所以溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.根据1.0mol/L Na2CO3溶液中的质子守恒可知:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.二元弱酸的酸式盐NaHA溶液中,根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选A.
点评:本题考查了盐的水解原理、溶液中离子浓度大小比较方法,题目难度中等,注意掌握盐的水解原理、溶液酸碱性与溶液pH的关系,能够根据电荷守恒、中子数、物料守恒等知识判断溶液中各离子浓度大小.

练习册系列答案
相关题目
下列各组物质在溶液中反应时,以任意比例混合均能用同一离子方程式表示的是( )
| A、AgNO3溶液和稀氨水 |
| B、Na2S和盐酸 |
| C、AlCl3溶液和氨水 |
| D、Fe和稀硝酸 |
在下列给定条件的溶液中,一定能大量共存的粒子组是( )
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | ||
B、常温下,
| ||
| C、水电离的c(H+)水=1.0×10-13mol?L-1溶液中:AlO2-、K+、SO42-、Br- | ||
| D、与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3- |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,4g CH4含NA个共价键 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6NA |
| D、0.1mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
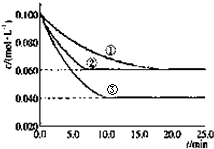 在密闭容器中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L;c(B)=0.200mol/L;c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在密闭容器中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L;c(B)=0.200mol/L;c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )| A、实验②平衡时B的转化率为60% |
| B、反应A(g)+2B(g)?C(g)的△H>0 |
| C、若反应①、②的平衡常数分别为K1、K2,则K1<K2 |
| D、减小反应③的压强,可以使平衡时c(A)=0.060mol/L |
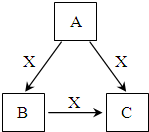 A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示的转化关系(其他产物已略去),下列说法不正确的是( )
A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示的转化关系(其他产物已略去),下列说法不正确的是( )| A、若X为O2,则A可能是金属单质,也可能是非金属单质 |
| B、若X为O2,则A可能是化合物 |
| C、若X为NaOH溶液,则A可能是化合物 |
| D、若X为NaOH溶液,则A可能为单质 |
某体积可变的密闭容器,盛有体积比为2:3的N2和H2,在一定条件下发生反应N2(g)+3H2(g)?2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V,其中NH3的体积占20%,下列说法正确的是( )
| A、原混合气体的体积为1.2V |
| B、原混合气体的体积为1.1V |
| C、反应中消耗N2的体积为0.3V |
| D、达到平衡时,消耗H2体积为0.1V |