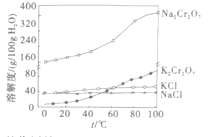
题目内容
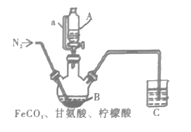
【题目】如图是我国科学家研制的一种新型化学电池,成功实现了废气的处理和能源的利用(H2R和R都是有机物)。下列说法不正确的是( )
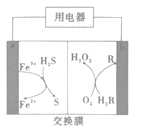
A.电池工作时,电子从电极b流出
B.负极区,发生反应2Fe3++H2S=2Fe2++S+2H+
C.电池工作时,负极区要保持呈酸性
D.电路中每通过2mol电子,理论上可处理标准状况下H2S22.4L
【答案】A
【解析】
根据图示,a电极生成Fe3+,生成Fe3+和H2S生成S和Fe2+,Fe2+在电极a处失去电子生成Fe3+,电极反应为Fe2+-e-=Fe3+,生成的Fe3+能够继续氧化H2S;b电极一侧,O2和H2R反应生成H2O2和R,R在电极b处得到电子和H+生成H2R,电极方程式为R+2e-+2H+=H2R,可知,电极a为负极,电极b为正极。
A.电池工作时,电子从负极流出,a为负极,电子从电极a流出,A错误,符合题意;
B.根据图示,负极区,Fe3+和H2S反应生成Fe2+和S,离子方程式为2Fe3++H2S=2Fe2++S+2H+,B正确,不选;
C.电池工作时,Fe3+与H2S反应,存在Fe3+的溶液为酸性,因此负极区需要保持酸性,防止Fe3+水解沉淀,C正确,不选;
D.根据电极反应,每通过2mol电子,能够生成2molFe3+,2molFe3+能够氧化1molH2S,则处理标准状况下H2S的体积为22.4L,D正确,不选。
答案选A。

【题目】芳香烃在工业生产中有着重要的用途。下列有关苯乙烯和2-苯基丙烯(![]() )的说法错误的是( )
)的说法错误的是( )
A.二者互为同系物
B.均能使澳水溶液褪色
C.分子中的所有原子均可能在同平面上
D.均能发生取代反应和加成反应
【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)