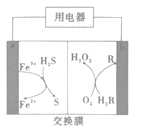
题目内容
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe,M=204g/mol]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某化学实验小组利用FeCO3与甘氨酸反应制备甘氨酸亚铁,实验过程如下:
已知:①甘氨酸亚铁易溶于水,难溶于酒精。②甘氨酸具有两性,易溶于水,微溶于酒精:柠檬酸易溶于水和酒精,具有强酸性和强还原性。
I.制备FeCO3:
实验小组将足量的废铁屑和500mL1.0mol·L-1稀硫酸反应,再与200mL1.0mol·L-1NH4HCO3溶液充分混合,装置如图,反应结束后过滤并洗涤沉淀。
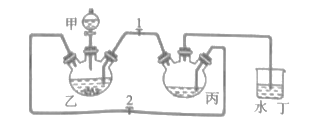
(1)仪器甲的名称为__。
(2)丙中发生反应的离子方程式为__。
(3)实验时先打开止水夹2,关闭止水夹1,加入药品,塞上塞子,待丁中产生大量气泡后,关闭止水夹2,打开止水夹1,观察到的现象为__。
II.制备(NH3CH2COO)2Fe:
将步骤I得到的沉淀全部转移到仪器B,同时加入200mL1.0mol·L-1甘氨酸溶液和适量柠檬酸。通入氮气,通过A向B中加入适量氢氧化钠溶液调节pH为6,充分反应。
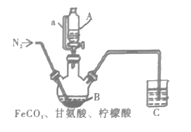
(4)仪器a的作用是__。
(5)实验过程前通入氮气的目的是__,C的导管插入液面下的作用是__。
(6)柠檬酸的作用是__。
(7)反应结束后,将B中液体蒸发浓缩,加入___(填试剂名称),过滤、洗涤并干燥得15.3g甘氨酸亚铁,则其产率是__%(假设上述各步反应均完全)。
【答案】分液漏斗 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 乙内有气泡产生,液体沿长导管进入丙,丙中产生沉淀 平衡气压,便于液体流下 排尽装置内的空气,防止氧化二价铁 便于吸收尾气,同时防止空气进入B中 促进FeCO3溶解和防止Fe2+被氧化 乙醇 75.0
【解析】
根据实验装置可知,将甲中盛有稀硫酸,乙中放置足量的废铁屑,二者反应生成FeSO4,再通过产生的氢气加压,流入丙装置与200mL1.0mol·L-1NH4HCO3溶液充分混合,产生FeCO3,最后与甘氨酸反应生成甘氨酸亚铁。柠檬酸具有强酸性可以提供氢离子,具有强还原性,可以抗氧化;由于甘氨酸亚铁易被氧化,反应过程中要隔绝空气,甘氨酸亚铁难溶于酒精,故可用酒精洗涤。
I (1)观察装置,可知仪器甲的名称为分液漏斗;
(2)丙中发生的反应为硫酸亚铁与碳酸氢铵反应生成碳酸亚铁沉淀,同时生成二氧化碳,离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)关闭止水夹2,打开止水夹1,乙中继续反应产生氢气,形成压强,从而将乙中液体压入装置丙,观察到的现象是乙内有气泡产生,液体沿长导管进入丙,丙中产生沉淀;
II (4)仪器a上下连通,作用是平衡气压,使液体顺利流下;
(5)亚铁离子具有还原性,易被空气中的氧气氧化,实验前通入氮气,排尽装置内的空气,防止氧化二价铁;将C中导管没入液面以下,可以充分吸收尾气,同时防止空气中的氧气进入B装置将亚铁离子氧化;
(6)根据题中的已知信息,柠檬酸具有强酸性和强还原性,合成过程加入柠檬酸的可促进FeCO3溶解和防止亚铁离子被氧化;
(7)依题意,甘氨酸亚铁难溶于酒精,加入乙醇可降低溶解度,使其结晶析出;稀硫酸和铁屑过量,碳酸氢铵的物质的量=0.2L×1.0mol·L-1=0.2mol,产生0.1mol的碳酸亚铁,根据铁原子守恒,0.2mol甘氨酸和0.1mol碳酸亚铁理论上生成0.1mol甘氨酸亚铁,理论上可产生甘氨酸亚铁的质量:204g·mol-1×0.1mol=20.4g,产品的质量为15.3g,则产率=![]() 。
。

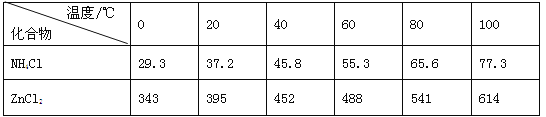
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。