题目内容
【题目】(1)中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑。
A+N2↑+3CO2↑。
①除S外,上列元素的电负性从大到小依次为____。
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为____,Q2+的未成对电子数是____。
【答案】O>N>C>K SP 1:1 3d84s2 4
【解析】
(1)由质量守恒定律可知A为K2S。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素。
(1)①金属元素电负性最小,则K元素的电负性最小,C、N、O为同周期元素,非金属性依次增强,电负性依次增大,则除S外,电负性从大到小依次为O>N>C>K,故答案为:O>N>C>K;
②在生成物中, K2S为离子化合物,只含有离子键,N2为只含有非极性键的单质,CO2为含有极性键的共价化合物,CO2分子中C原子的价层电子对数为2,孤对电子数为0,则C原子为sp杂化,故答案为:sp;
③由CN-与N2结构相似可知,HCN分子中含有1个碳氢σ键和1个碳氮σ键,2个碳氮π键,则HCN分子中σ键与π键数目之比为1:1,故答案为:1:1;
(2)Ni元素是28号元素,价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个未成对电子,故答案为:3d84s2;4。

 全能练考卷系列答案
全能练考卷系列答案【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
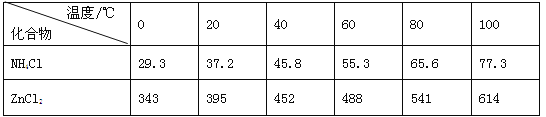
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。