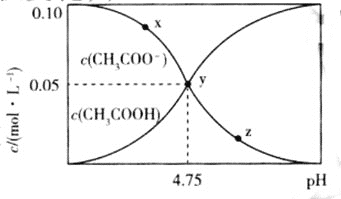
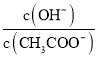题目内容
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
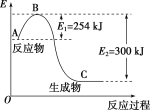
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式:____________________________________。
(2)已知化学键键能是形成或断裂1mol化学键放出或吸收的能量,单位为kJ·mol-1。
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及(1)的图中数据计算N—H键的键能为________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。例如:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
若1molNH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ·mol-1(用含a、b的式子表示)。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为____________。
【答案】N2(g)+3H2(g)=2NH3(g)ΔH=-92kJ·mol-1 390kJ·mol-1 ![]() 2NH3-6e-+6OH-=N2+6H2O
2NH3-6e-+6OH-=N2+6H2O
【解析】
(1)据图可知N2(g)和H2(g)反应生成1molNH3(g)过程中放出300kJ-254kJ=46kJ能量,则反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol;
(2)设N-H的键能为akJ/mol,△H=反应物键能之和-生成物键能之和=943kJ/mol+3×435kJ/mol-6×akJ/mol=-92kJ/mol,解得a=390 ;
(3)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)ΔH1=-akJ·mol-1①
N2(g)+O2(g)=2NO(g)ΔH2=-bkJ·mol-1②
根据盖斯定律![]() 可得NH3(g)+
可得NH3(g)+![]() NO(g)=
NO(g)=![]() N2(g)+
N2(g)+![]() H2O(g)△H3=
H2O(g)△H3=![]() kJ/mol;
kJ/mol;
(4)氨气在纯氧中燃烧,生成一种单质和水,根据元素守恒可知该单质为N2,所以通入氨气的电极失电子发生氧化反应,电解质溶液显碱性,所以生成N2和H2O,电极反应式为2NH3-6e-+6OH-=N2+6H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
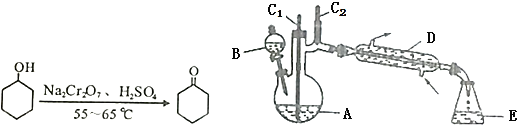
有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;(![]() 被还原为Cr3+)
被还原为Cr3+)
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)