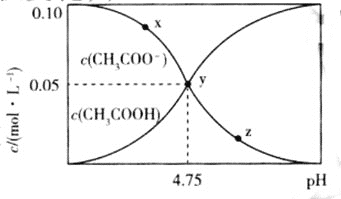
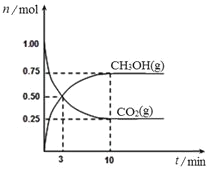
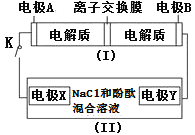
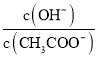题目内容
【题目】氯丁橡胶M是理想的电线电缆材料,工业上可由有机化工原料A或E制得,其合成路线如下图所示。

完成下列填空:
(1)A的名称是_______,反应③的反应类型是_____。
(2)写出反应②的化学反应方程式_____。
(3)为研究物质的芳香性,将E三聚、四聚成环状化合物,写出它们的结构简式_____。鉴别这两个环状化合物的试剂为_______。
(4)以下是由A制备工程塑料PB的原料之一1,4-丁二醇(BDO)的合成路线:
![]()
写出上述由A制备BDO的化学反应方程式__________。
【答案】1,3—丁二烯 加聚反应 CH2=CHCHClCH2Cl+KOH 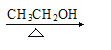 CH2=CHCCl=CH2+H2O+KCl )
CH2=CHCCl=CH2+H2O+KCl )![]() 、
、![]() 溴水或酸性高锰酸钾溶液 CH2=CHCH=CH2+Cl2
溴水或酸性高锰酸钾溶液 CH2=CHCH=CH2+Cl2![]() ClCH2CH=CHCH2Cl、ClCH2CH=CHCH2Cl+2NaOH
ClCH2CH=CHCH2Cl、ClCH2CH=CHCH2Cl+2NaOH![]() HOCH2CH=CHCH2OH+2NaCl、HOCH2CH=CHCH2OH+H2
HOCH2CH=CHCH2OH+2NaCl、HOCH2CH=CHCH2OH+H2![]() HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2OH
【解析】
根据氯丁橡胶M的结构简式可知,C的结构简式为CH2=CHCCl=CH2;A与氯气反应生成B,则根据A的分子式可知,A的结构简式为CH2=CHCH=CH2,因此B的结构简式为CH2=CHCHClCH2Cl,根据B和C的结构简式可知,B→C发生了消去反应;C发生加聚反应生成高分子M;E二聚得到CH2=CHC≡CH,则E是乙炔;据以上分析解答。
(1)结合以上分析可知,A的结构简式为CH2=CHCH=CH2,A的名称是1,3—丁二烯,反应③的反应类型是加聚反应;
(2)反应②是卤代烃的消去反应,反应的化学反应方程式为CH2=CHCHClCH2Cl+KOH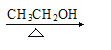 CH2=CHCCl=CH2+H2O+KCl;
CH2=CHCCl=CH2+H2O+KCl;
(3)E二聚得到CH2=CHC≡CH,则E是乙炔,因此乙炔三聚、四聚成环状化合物的结构简式分别为![]() 、
、![]() 。苯不能使酸性高锰酸钾溶液褪色,也不能与溴水发生反应导致溴水褪色,而
。苯不能使酸性高锰酸钾溶液褪色,也不能与溴水发生反应导致溴水褪色,而![]() 含有碳碳双键,能使酸性高锰酸钾溶液褪色或溴水褪色,则鉴别这两个环状化合物的试剂为酸性高锰酸钾溶液或溴水;
含有碳碳双键,能使酸性高锰酸钾溶液褪色或溴水褪色,则鉴别这两个环状化合物的试剂为酸性高锰酸钾溶液或溴水;
(4)要得到1,4-丁二醇,则需要ClCH2CH2CH2CH2Cl进行水解反应,因此可以利用1,3—丁二烯发生1,4—加成,最后再与氢气加成即可,则有关反应的化学方程式为CH2=CHCH=CH2+Cl2![]() ClCH2CH=CHCH2Cl;ClCH2CH=CHCH2Cl+2NaOH
ClCH2CH=CHCH2Cl;ClCH2CH=CHCH2Cl+2NaOH![]() HOCH2CH=CHCH2OH+2NaCl;HOCH2CH=CHCH2OH+H2
HOCH2CH=CHCH2OH+2NaCl;HOCH2CH=CHCH2OH+H2![]() HOCH2CH2CH2CH2OH。
HOCH2CH2CH2CH2OH。

【题目】I.有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是___。
(2)C元素的气态氢化物的化学式为:___;其检验方法:___。
(3)B元素在周期表中的位置___;离子半径:B___A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___,与D的氢化物的水化物反应的离子方程式为___。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c/span>(NO)=___。
(2)图中表示NO2变化的曲线是___,用O2表示0~2s内该反应的平均速率υ=___。
(3)能说明该反应已达到平衡状态的是___。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变