题目内容
【题目】25℃时,向20mL0.0100mol/L苯酚(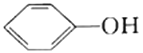 )溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
)溶液中滴加0.0100mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是
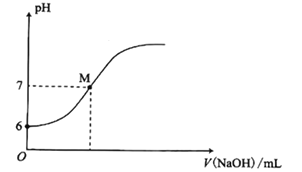
A. 25℃时,苯酚的电离常数Ka约为1.0×10-4
B. M点时,所加人NaOH溶液的体积大于10mL
C. M点时,溶液中的水不发生电离
D. 加入20mLNaOH溶液时,溶液中c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() )
)
【答案】D
【解析】
A.由图像中的信息可知0.01molL-1的苯酚溶液的pH=6,则c(![]() )≈c(H+)=10-6mol·L-1,根据苯酚的电离平衡常数表达式进行计算
)≈c(H+)=10-6mol·L-1,根据苯酚的电离平衡常数表达式进行计算![]() ,故A错误;B.当NaOH溶液的体积等于10mL时,相当于溶液中的苯酚钠和苯酚的物质的量相等,又知道苯酚钠的水解程度大于苯酚的电离程度,所以溶液会显碱性,那么M点对应pH=7的溶液加入的NaOH溶液的体积小于10mL,故B错误;C.水的电离是始终存在的,故C错误;D.加入20mLNaOH溶液时存在物料守恒c(Na+)=c(
,故A错误;B.当NaOH溶液的体积等于10mL时,相当于溶液中的苯酚钠和苯酚的物质的量相等,又知道苯酚钠的水解程度大于苯酚的电离程度,所以溶液会显碱性,那么M点对应pH=7的溶液加入的NaOH溶液的体积小于10mL,故B错误;C.水的电离是始终存在的,故C错误;D.加入20mLNaOH溶液时存在物料守恒c(Na+)=c(![]() )+c(
)+c(![]() ),同时存在电荷守恒c(Na+)+c(H+)=c(
),同时存在电荷守恒c(Na+)+c(H+)=c(![]() )+c(OH-),两个等式联立可以得到c(OH-)-c(H+)=2c(Na+)-2c(
)+c(OH-),两个等式联立可以得到c(OH-)-c(H+)=2c(Na+)-2c(![]() )-c(
)-c(![]() ),故D正确。
),故D正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目