题目内容
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途。
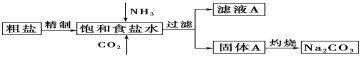
Ⅰ.以下是实验室模拟制碱原理制取Na2CO3的流程图。
下表是四种物质在100g水中不同温度的溶解度

(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→________→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣 b.加入盐酸调pH c.加入Ba(OH)2溶液
d.加入Na2CO3溶液 e.过滤
(2)向饱和食盐水中先通入_______,后通入________,生成固体A的化学方程式为____
Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把6g样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后得到5g固体。
(3)洗涤沉淀的具体操作是_____________________________。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
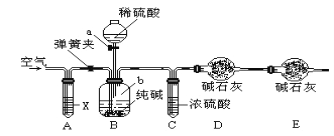
已知:碱石灰为氢氧化钠和氧化钙的混合物。
(5)实验开始前应进行的操作是______________________________。
(6)仪器a的名称为___________________,装置A中试剂X应选用_________________。
(7)装置E的作用是_________________________________。
【答案】c d e NH3 CO2 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次 88.3% 检查装置气密性 分液漏斗 NaOH溶液 吸收空气中的水蒸气和CO2
【解析】
Ⅰ.(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液反应生成硫酸钡、氢氧化镁、碳酸钙沉淀,过量的Na2CO3溶液能除去过量的Ba(OH)2溶液,然后可再通过过滤除去沉淀,盐酸能除去过量的Na2CO3溶液,据以上分析解答。
(2) NH3易溶于水,溶液显碱性,有利于吸收溶解度不大的CO2;氨气、二氧化碳、氯化钠和水共同作用生成氯化铵和碳酸氢钠,据此写出方程式;
Ⅱ.方案一:固液分离开后,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
因为氯化钙与碳酸钠反应生成碳酸钙沉淀,所以根据n(CaCO3)=n(CO32-) =n(Na2CO3)关系可以计算出样品中碳酸钠的质量,从而计算样品的质量分数。
方案二:本实验是通过碳酸钠和硫酸反应产生二氧化碳,用碱石灰来吸收二氧化碳,根据产生二氧化碳的质量来计算碳酸钠的质量,进而计算质量分数,故实验过程中应防止空气中水和二氧化碳干扰实验,把产生的二氧化碳全部被碱石灰吸收;实验开始前要检查装置的气密性;根据装置的特点及实验目的,分析鼓入空气这一操作的目的和装置A中碱液的作用;可以根据空气中的成分来分析装置E在整个装置中所起到的作用。
Ⅰ.(1)(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液反应生成硫酸钡、氢氧化镁、碳酸钙沉淀,过量的Na2CO3溶液能除去过量的Ba(OH)2溶液,然后可再通过过滤除去沉淀,盐酸能除去过量的Na2CO3溶液;综上分析可知精制除杂的步骤顺序是a→c→d→e→b;
因此,本题正确答案是:c;d;e;
(2)NH3易溶于水,有利于吸收溶解度不大的CO2,所以向饱和食盐水中先通入NH3,后通人CO2;反应的方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
因此,本题正确答案是:NH3,CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
Ⅱ.(3) 样品溶解后加入过量的CaCl2溶液会生成碳酸钙沉淀,分离固液混合物的方法为过滤,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
综上所述,本题答案是:加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次。
(4)碳酸钠与氯化钙反应生成碳酸钙沉淀,将所得沉淀过滤、洗涤、烘干后得到5g固体碳酸钙,其物质的量为0.05mol,则n(CaCO3)=n(CO32-)=n(Na2CO3)=0.05 mol,所以碳酸钠的质量为0.05×106=5.3g,纯碱样品Na2CO3的质量分数为5.3/6×100%=88.3%;
综上所述,本题答案是:88.3%。
(5)进行气体的制备或验证性实验之前,都要检查装置气密性,以防装置漏气,影响实验或带来危险;综上所述,本题答案是:检查装置气密性。
(6)仪器a为控制滴加液体的玻璃仪器,其名称为分液漏斗;根据题意可以知道我们是通过测定二氧化碳的质量来测定碳酸钠的质量分数的,所以要排除空气中的二氧化碳干扰实验结果,因此在A中装了碱性溶液来吸收空气中的二氧化碳,故装置A中试剂可选用NaOH溶液 ;
综上所述,本题答案是:分液漏斗;NaOH溶液。
(7) 如果D装置直接与外界空气相连通,则空气中的水蒸气和二氧化碳会进入D装置而对测定结果产生影响,所以装置E的作用则是防止空气中水蒸气和二氧化碳进入装置D中;
因此,本题正确答案是: 吸收空气中的水蒸气和CO2。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案