题目内容
【题目】某同学欲从Fe3+、Al3+的混合液中分离并测定Fe3+的浓度,实验方案如下:

已知:①乙醚[(C2H5)2O]:沸点34.5℃,微溶于水,易燃。
②盐酸浓度较高时,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]溶于乙醚;当盐酸浓度降低时,该化合物解离。
(1)操作I的名称是_______。
(2)检验溶液Y中是否残留Fe3+的实验方法是_________ 。
(3)蒸馏装置如下图所示,该装置图中存在的错误是________。

(4)滴定前,加入的适量溶液Z是_______(填序号)。
A.H2SO4~H3PO4 B.H2SO3~H3PO4 C.HNO3~H3PO4 D.HI~H3PO4
(5)滴定达到终点时,消耗0.1000mol/LK2Cr2O7溶液5.00mL。根据该实验数据,起始所取的试样Fe3+、Al3+的混合液中c(Fe3+)为______。
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是_______。
A.稀释被测试样 B.增加平行测定次数
C.减少被测试样取量 D.降低滴定剂浓度
【答案】 萃取、分液 取溶液Y少许,滴加KSCN溶液,若不显血红色说明无Fe3+残留 温度计的水银球应与蒸馏烧瓶的支管口相平;用明火加热,易导致乙醚着火 A 0.4800mol/L BD
【解析】分析:含Fe3+、Al3+试样X溶液25mL,加入适量浓盐酸和乙醚,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Y为Al3+的溶液,和溶液X是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,当盐酸浓度降低时,该化合物解离,加入水解离后,通过蒸馏得到方法除去乙醚,得到含铁离子的水溶液,定容至100mL,取25.00mL溶液,滴入适量还原剂得到Fe2+离子的溶液,加入指示剂,滴定前,加入的适量溶液Z,用重铬酸钾溶液滴定至终点。
详解:(1)操作A是利用在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,乙醚微溶于水,分层后通过分液分离得到溶液Ⅱ为Al3+的溶液,和溶液Ⅰ是乙醚形成化合物[(C2H5)2OH][FeCl4]的溶液,分离的名称为萃取、分液,故答案为:萃取、分液;
(2)依据铁离子遇到KSCN溶液变红色设计实验检验铁离子的存在,从溶液Y中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留,故答案为:从溶液Y中取样,滴加KSCN溶液,显红色证明残留含有Fe3+,显无色证明无残留;
(3)乙醚是一种易挥发、易燃、有麻醉性的有机化合物,实验加热不能用明火,否则会引发燃烧导致危险;温度计的水银球应与蒸馏烧瓶的支管口相平,测蒸气的温度,故答案为:温度计的水银球应与蒸馏烧瓶的支管口相平;用明火加热,易导致乙醚着火;
(4)滴定需要的酸性环境,所需酸不能具有还原性、氧化性,不能被氧化剂氧化,也不能被亚铁离子还原。A.H2SO4-H3PO4 中酸为非氧化性酸,可以提供酸性环境且不影响测定反应,故A正确;B.H2SO3-H3PO4 中亚硫酸具有还原性,也会被氧化剂氧化,消耗标准溶液增大,产生误差,故B错误;C.HNO3-H3PO4 中硝 酸具有强氧化性,可以氧化亚铁离子,导致滴入氧化剂标准溶液减少,测定结果偏低,故C错误;D.HI-H3PO4 中HI酸是还原性酸,也可以消耗滴入的氧化剂,导致测定结果偏高,故D错误;故答案为:A;
(5)依据离子反应定量关系计算,定达到终点时,消耗0.1000 molL-1K2Cr2O7溶液6.00mL,物质的量=0.1000mol/L×0.0050L=0.0005mol,
反应为 Cr2O7 2- + 6Fe2++H+=2Cr3++6Fe3++7H2O
1 6
0.0005mol 0.0030mol
c=![]() =0.1200mol/L,则试样X中c(Fe3+)=0.1200mol/L×
=0.1200mol/L,则试样X中c(Fe3+)=0.1200mol/L×![]() =0.4800mol/L,故答案为:0.4800mol/L;
=0.4800mol/L,故答案为:0.4800mol/L;
(6)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可以重复几次实验,数值取平均值,减少误差,滴定溶液浓度越小,测定结果越准确。A.稀释被测试样,浓度减小,测定误差会增大,故A错误;B.增加平行测定次数,减少测定带来的误差,可以提高准确度,故B正确;C.减少被测试样取量,和滴定结果的精密度和准确度无关,故C错误;D.降低滴定剂浓度,反应终点判断更准确.滴定结果的精密度高,故D正确;故答案为:BD。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】利用下图装置可以进行实验并能达到实验目的的是
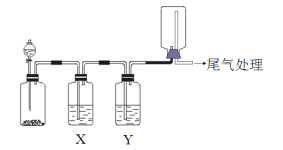
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4溶液 |
A. A B. B C. C D. D