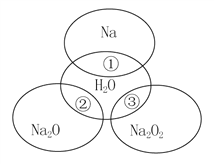
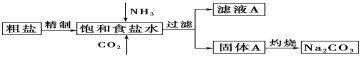
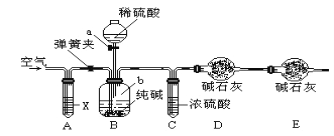
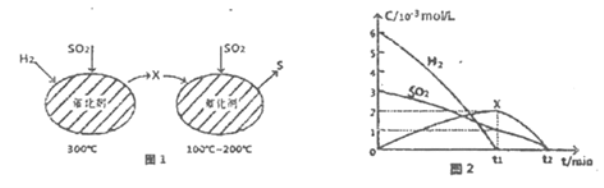
题目内容
【题目】环境监测站经常测定水中溶解氧的情况,主要步骤是量取100mL水样,迅速加入固定剂MnSO4和碱性KI(含KOH)溶液,完全反应后加入硫酸使之生成I2,再用0.0040mol/L的Na2S2O3溶液与之反应。有关反应的化学方程式为:
①2MnSO4+O2+4KOH=2MnO(OH)2+2K2SO4(该反应极快)
②MnO(OH)2+2KI+2H2SO4=MnSO4+I2+K2SO4+3H2O
③I2+2Na2S2O3=2NaI+Na2S4O6
(1)若该水样消耗20.00mLNa2S2O3溶液,所耗Na2S2O3的物质的量为________mol。
(2)试计算该水样中的溶解氧_____(g/L)。
【答案】 8×10-5 设该水样中溶解的O2质量为x
O2~2MnO(OH )2~2I2~4Na2S2O3
32g 4mol
x 8×10-5mol
![]() =
=![]()
x=6.4×10-4g
![]() =6.4×10-3g/L
=6.4×10-3g/L
【解析】(1)若该水样消耗20.00mLNa2S2O3溶液,则所耗Na2S2O3的物质的量为0.02L×0.0040mol/L=8×10-5mol。(2)设该水样中溶解的O2质量为x,根据方程式可知
O2~2MnO(OH)2~2I2~4Na2S2O3
32g 4mol
x 8×10-5mol
![]() =
=![]()
解得x=6.4×10-4g
所以该水样中的溶解氧为![]() =6.4×10-3g/L
=6.4×10-3g/L

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1