题目内容
【题目】关键环节考核:
(1)将AgNO2和AgCl的饱和溶液等体积混合后,加入足量的硝酸银溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知该温度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________________。
学法题:通过上题第(2)问的计算,请思考利用溶度积常数(Ksp)进行定量计算,代入离子浓度时需要注意的关键是什么?__________
【答案】大于 6.2×10—4 mol/L 该时刻溶液中离子的浓度,溶液等体积混合时,浓度需要减半。
【解析】
溶液沉淀平衡常数为Ksp,对于某沉淀溶解平衡:MmAn(s)![]() mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,Ksp越小,越容易沉淀。两溶液混合后,平衡向着更难溶的沉淀方向移动,据此回答问题。
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,Ksp越小,越容易沉淀。两溶液混合后,平衡向着更难溶的沉淀方向移动,据此回答问题。
(1)已知该温度下,Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10,在AgCl和AgNO2饱和溶液中, c(NO2-)> c(Cl-),当将AgCl、AgNO2两饱和溶液混合时,平衡向着更难溶的方向移动,产生AgCl沉淀。加入足量的浓AgNO3溶液时,AgCl沉淀有所增多,但溶液中c(NO2-)大,产生的AgNO2沉淀更多;
(2) ![]() =3.1×10-7,等体积混合后SO32-溶液浓度为1×10-3 mol·L-1,生成沉淀时
=3.1×10-7,等体积混合后SO32-溶液浓度为1×10-3 mol·L-1,生成沉淀时![]() ,即混合前所需CaCl2溶液的最小浓度为6.2×10—4 mol/L。解题中需要注意:两溶液等体积混合,混合后溶质的物质的量浓度是混合前的一半。
,即混合前所需CaCl2溶液的最小浓度为6.2×10—4 mol/L。解题中需要注意:两溶液等体积混合,混合后溶质的物质的量浓度是混合前的一半。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)在某一容积为2L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:
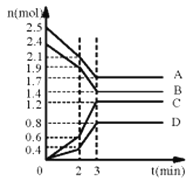
回答下列问题:
①该反应的化学方程式为___。
②前2min用A的浓度变化表示的化学反应速率为__。在2min时,图像发生改变的原因可能是__(填字母)。
a.增大压强 b.降低温度 c.加入催化剂 d.增加A的物质的量
(2)在100℃时,将0.01mol的N2O4气体充入0.1L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | a | b | c |
c(NO2)/mol·L-1 | 0.000 | 0.060 | d | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式__,达到平衡时N2O4的转化率为__。
②在0~20s内,四氧化二氮的平均反应速率为__。