题目内容
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
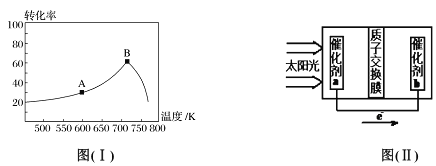
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
【答案】 N2(g)+O2(g)===2NO(g) △H=+183kJ/mol 50% > A 正反应为放热反应,温度升高,平衡向左移动,K变小 c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11 CO2+2e-+2H+=HCOOH
【解析】(1)①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)△H1=-748kJ·mol-1,
2CO2(g)+N2(g)△H1=-748kJ·mol-1,
②2CO(g)+O2(g)═2CO2(g)△H2=-565kJ·mol-1在一定条件下N2和O2会转化为NO气体,反应的热化学方程式依据盖斯定律计算②-①得到:N2(g)+O2(g)═2NO(g)△H=+183KJ/mol;答案为:N2(g)+O2(g)===2NO(g) △H=+183kJ/mol
(2)结合化学平衡三段式列式计算,测得10min内v(NO)=7.5×10-3mol·L-1·min-1,反应消耗物质的量=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始量(mol)0.3 0.200
变化量(mol)0.150.150.150.075
平衡量(mol)0.150.050.150.075
平衡后CO的转化率为: ![]() 50% 答案为:50%
50% 答案为:50%
(3)NO的转化率开始随温度升高增大,到B点后减小,说明正反应是放热反应,而且B点是平衡状态,则A点是建立平衡的过程,则A点的反应速率:v正>v逆,平衡逆向进行,平衡常数减小,平衡常数较大的是A点。答案为:> 、A、正反应为放热反应,温度升高,平衡向左移动,K变小
(4)由于Ka(HNO2)>Kb(NH3·H2O),根据盐类水解规律,NH4NO2溶液水解显酸性,因此NH4NO2溶液中离子浓度大小为:c(NO2-)>c(NH4+)>c(H+)>c(OH-) ,依据NO2﹣+H2O![]() HNO2+OH﹣,水解平衡常数表达式Kh=
HNO2+OH﹣,水解平衡常数表达式Kh=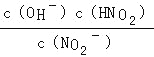 ,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=
,分子和分母都乘以氢离子浓度得到水解平衡常数Kh=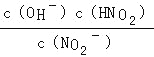 ×
×![]() =
=![]() =
=![]() =1.4×10﹣11. 答案为:c(NO2-)>c(NH4+)>c(H+)>c(OH-)、1.4×10-11
=1.4×10﹣11. 答案为:c(NO2-)>c(NH4+)>c(H+)>c(OH-)、1.4×10-11
(5)催化剂b表面的反应是通入二氧化碳,酸性条件下生成HCOOH,电极反应为:CO2+2e-+2H+=HCOOH,答案为:CO2+2e-+2H+=HCOOH