题目内容
【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:
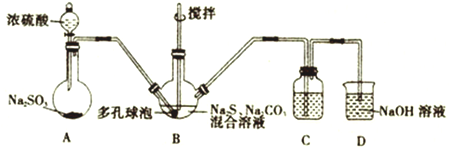
①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。
【答案】 Na2SO3+H2SO4==Na2SO4+H2O+SO2↑ 没有打开分液漏斗上的玻璃塞 2S2-+CO32-==3S2O32-+CO2↑ 品红溶液(或溴水或KMnO4溶液) C中溶液颜色较快褪去 控制SO2的流速(或适当升高B中溶液温度) 取一片pH试纸在玻璃片上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比 氯水颜色变浅,甚至褪去 S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
【解析】本题主要考查对于实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质实验的评价。
(1)①装置A中发生强酸硫酸制取弱酸亚硫酸的反应,反应的化学方程式为Na2SO3+H2SO4==Na2SO4+H2O+SO2↑。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是没有打开分液漏斗上的玻璃塞,造成漏斗内气压小于大气压。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为2S2-+CO32-==3S2O32-+CO2↑。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为品红溶液(或溴水或KMnO4溶液),当B中SO2的吸收效率低时,C中的现象为C中溶液颜色较快褪去,除搅拌和使用多孔球泡外,另一种提高B中SO2的吸收效率的方法:控制SO2的流速(或适当升高B中溶液温度)。
(2)①探究1中的实验操作为取一片pH试纸在玻璃片上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比。
②探究2中的实验现象为氯水颜色变浅,甚至褪去,反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案