题目内容
【题目】如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( ) 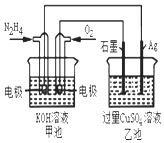
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体
【答案】C
【解析】解:A.甲池中为原电池反应,对应的电极反应式是:正极O2+4e﹣+2H2O=4OH﹣,负极N2H4﹣4e﹣+4OH﹣=N2+4H2O,故A错误;B.甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,故B错误;
C.乙池发生的是电解池反应,其电解总反应的离子方程式为:2Cu2++2H2O ![]() 2Cu+4H++O2↑,两极析出的分别是Cu和O2 , 因而加CuO后溶液能够复原,故C正确;
2Cu+4H++O2↑,两极析出的分别是Cu和O2 , 因而加CuO后溶液能够复原,故C正确;
D.选项中没说明气体的体积是否是标准状况下,所以气体的物质的量无法计算,则乙中生成的固体的质量也无法计算,故D错误.
故选C.
A.甲池中为原电池反应,N2H4失电子生成氮气;
B.根据电池的总反应判断PH的变化;
C.乙池发生的是电解池反应两极析出的分别是Cu和O2 , 因而加CuO后溶液能够复原;
D.选项中没说明气体的体积是否是标准状况下.

【题目】五种短周期元素D,E,F,X,Y,Z的原子序数依次增大,D,E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品.回答下列问题:
①E元素在元素周期表中的位置是 .
②由D和F,Y,Z所形成的最简单常见共价型化合物中,还原性最强的是(用化学式表示).
③F,X,Z形成的简单离子半径从大到小顺序为(用离子符号表示).
④X与Z能形成一种离子化合物,用电子式表示其形成过程: .
⑤2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是 .
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |