题目内容
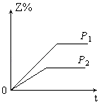
【题目】将一小块铝片加入某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加入的NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
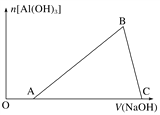
A. C点的溶质只有NaAlO2
B. 图中B点之前发生的离子反应为Al3++3OH-===Al(OH)3↓
C. A→B段消耗的NaOH溶液体积与B→C段消耗的NaOH溶液体积比=3∶1
D. 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
【答案】C
【解析】在O→A段,还发生了H++OH-=H2O的反应,AB段生成氢氧化铝:Al3++3OH-=Al(OH)3↓,BC段溶解氢氧化铝:Al(OH)3+OH-=AlO2-+2H2O。
A、OB段均生成NaCl,留在溶液中,C点的溶质有NaAlO2和NaCl,故A错误;B、图中B点之前发生的离子反应为H++OH-=H2O和Al3++3OH-=Al(OH)3↓,故B错误;C、A→B段Al3++3OH-=Al(OH)3↓消耗的NaOH溶液体积为3份,与B→C段Al(OH)3+OH-=AlO2-+2H2O消耗的NaOH溶液体积为1份,体积比=3∶1,故C正确;D、溶解铝片的盐酸浓度与滴加的NaOH溶液浓度,根据题目提供条件,无法判断盐酸与NaOH溶液浓度的关系,故D错误;故选C。

练习册系列答案
相关题目