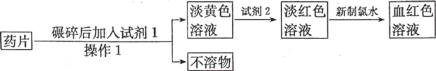
题目内容
【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
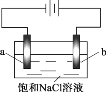
下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO
【答案】C
【解析】
用惰性电极电解饱和食盐水,电解的总方程式是:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,阳极发生氧化反应,阴极发生还原反应,溶液中阳离子向阴极定向移动,阴离子向阳极定向移动,据此分析。
Cl2↑+H2↑+2NaOH,阳极发生氧化反应,阴极发生还原反应,溶液中阳离子向阴极定向移动,阴离子向阳极定向移动,据此分析。
A.根据图示可知a电极为阴极,溶液中的阳离子H+在阴极上获得电子,发生还原反应,A正确;
B.在a电极溶液中的H+获得电子,变为H2逸出,附近溶液中OH-增多阴极产生NaOH,在阳极b电极上溶液中阴离子Cl-失去电子变为Cl2,Cl2与溶液中的NaOH发生反应:Cl2+2NaOH =NaCl+NaClO+H2O,B正确;
C.电解时阴离子OH- 向正电荷较多的阳极移动,即会由a极向b极移动,C错误;
D.实验③电压高,电流大,反应速率快,反应产生的氯气未能与NaOH溶液反应,就会从溶液中逸出,所以不能采用该电压制备NaClO,D正确;
故合理选项是C。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D