题目内容
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )
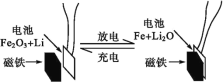
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
【答案】A
【解析】
由图可知该电池放电时负极电极反应为Li-e-=Li+,正极Fe2O3+6Li++6e-=2Fe+3Li2O,充电时,阳极、阴极电极反应与正负极正好相反,据此判断。
A. 正极发生还原反应,Fe2O3得电子被还原,所以放电时电池正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe,A项正确;
B. 锂与水能发生反应,所以不可以用水溶液作电解质溶液,B项错误;
C. 放电时,Li作电池的负极,Fe2O3作电池的正极,C项错误;
D. 充电时,Fe作为阳极生成Fe2O3,磁铁不可吸引Fe2O3,D项错误。

练习册系列答案
相关题目
【题目】在不同电压下用惰性电极电解饱和NaCl溶液制备少量NaClO,实验结果如下:
实验 | ① | ② | ③ |
电压 | U1 | U2 | U3 |
现象 | a极产生少量气泡,b极无明显气泡 | a极产生较多气泡,b极产生少量气泡 | a极产生大量气泡,b极逸出大量黄绿色气体 |
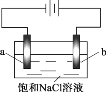
下列分析不正确的是
A. ①、②、③中,a极均发生了还原反应
B. ①、②、③中均能发生Cl2+2NaOH =NaCl+NaClO+H2O
C. 电解时OH- 由b极向a极移动
D. 不宜采用实验③的电压制备NaClO