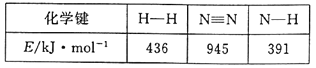
题目内容
【题目】某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和SiO2杂质。称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。(提示:SiO2杂不与稀硫酸反应)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式___。
(2)该样品中,Fe2O3的物质的量___。
(3)铝土矿样品中Al2O3的质量___。
(4)试计算样品中Al2O3·xH2O的x值___。(要求计算过程)
【答案】Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O等 0.01mol 10.2g 3
【解析】
氧化铝、氧化铁与硫酸反应,而二氧化硅不反应,故0.3g为二氧化硅的质量,滤液中加入足量的氢氧化钠,铝离子转化为偏铝酸盐,故得到沉淀2.14g为氢氧化铁的质量。
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水,任意两个反应离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
答:任意两个离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O等;
(2)根据Fe元素守恒,n(Fe2O3)=![]() n[Fe(OH)3]=
n[Fe(OH)3]=![]() ×
×![]() =0.01mol,
=0.01mol,
答:该样品中,Fe2O3的物质的量为0.01mol;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),即3n[Al2(SO4)3]+3×0.01mol=0.2L×1.65mol/L,则n[Al2(SO4)3]=0.1mol,根据Al元素守恒,n(Al2O3)=n[Al2(SO4)3]=0.1mol,故m(Al2O3)=0.1mol×102g/mol=10.2g,
答:铝土矿样品中Al2O3的质量为10.2g;
(4)样品中水的质量为17.5g-0.3g-10.2g-0.01mol×160g/mol=5.4g,物质的量为![]() =0.3mol,则0.1mol:0.3mol=1:x,故x=3,
=0.3mol,则0.1mol:0.3mol=1:x,故x=3,
答:样品中Al2O3.xH2O的x值为3。