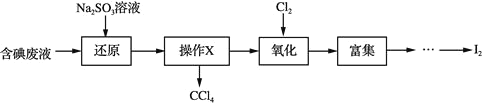
题目内容
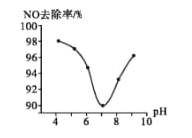
【题目】向1L的密闭容器中加入1mol X、0.3molZ和一定量的Y三种气体,一定条件下发生反应,各物质的浓度随时间变化如图一所示,图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
A.Y的起始物质的量为0.5mol
B.该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·(L·min)-1
D.反应物X的转化率t6点比t3点高
【答案】B
【解析】
先分析图二:t2~t3阶段,增大某反应物或生成物的浓度;t3~t4阶段,增大某条件,正、逆反应速率同等程度增大,平衡不发生移动,则应为加入催化剂(考虑到t4~t5阶段的条件改变);t4~t5阶段,应为减小压强,正、逆反应速率同等程度减小,平衡不发生移动,反应物与生成物的气体分子数相等;t5~t6阶段,应为升高温度,正、逆反应速率都增大,但正反应速率增大更多,说明平衡正向移动,应为升高温度,ΔH>0。
再分析图一:从浓度变化看,X为反应物,Z为生成物,它们的浓度变化量分别为0.2mol/L、0.3mol/L,则化学计量数分别为2和3,由图二的推断可知,反应前后气体的分子数相等,故Y为反应物,且化学计量数为1。
A.由上面分析知,在反应方程式中,2molX 与1molY完全反应,则X的浓度变化为0.2mol/L,Y的浓度变化为0.1mol/L,Y的平衡浓度为0.4mol/L,所以Y的起始物质的量为0.5mol,A正确;
B.由前面分析可知,X、Y为反应物,Z为生成物,且浓度变化量之比为2:1:3,反应吸热,所以该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH>0,B不正确;
3Z(g) ΔH>0,B不正确;
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=![]() =0.03mol·(L·min)-1,C正确;
=0.03mol·(L·min)-1,C正确;
D.t3~t4阶段X的转化率不变,t4~t5阶段X的转化率不变,t5~t6阶段平衡正向移动,X的转化率增大,所以反应物X的转化率t6点比t3点高,D正确;
故选B。

 名校课堂系列答案
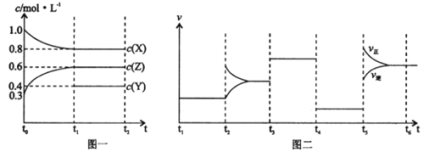
名校课堂系列答案【题目】下表提供的试剂,用如图所示装置,能制备相应气体的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
A. | 浓盐酸 | 二氧化锰 | 饱和食盐水 | 制备并收集氯气 |
B. | 稀盐酸 | 石灰石 | 浓硫酸 | 制备并收集二氧化碳 |
C. | 稀硫酸 | 粗锌 | 浓硫酸 | 制备并收集氢气 |
D. | 稀硝酸 | 铜粉 | 浓硫酸 | 制备并收集一氧化氮 |
A.AB.BC.CD.D