题目内容
【题目】合成氨工业的核心反应是N2(g)+3H2(g) ![]() 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。
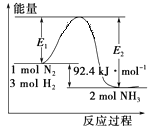
(1)该反应的ΔH=_______kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1 _____(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量_________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol 4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol,则该温度下白磷转化为红磷的热化学方程式:________________________________________________________。
【答案】-92.4 减小 < D P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol
【解析】
(1)从图中采集数据,可得出该反应的ΔH。
(2)催化剂可降低反应的活化能,使反应速率增大。
(3)合成氨反应为可逆反应,反应物不可能全部转化为生成物,由此可求出向一密闭容器中充入0.5mol N2和1.5mol H2,放出的热量。
(4)该反应为放热的、体积缩小的可逆反应,由此可确定ΔH<0,ΔS<0。
(5)P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol ①
4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2 =-2954kJ/mol ②
利用盖斯定律,将①-②,即得该温度下白磷转化为红磷的热化学方程式。
(1)从图中采集数据,可得出该反应的ΔH= -92.4kJ/mol。答案为:-92.4;
(2)催化剂可降低反应的活化能,使反应速率增大,E1减小。答案为:减小;
(3)合成氨反应为可逆反应,反应物不可能全部转化为生成物,则0.5mol N2和1.5mol H2放出的热量<46.2 kJ。答案为:<;
(4)该反应为放热的、体积缩小的可逆反应,由此可确定ΔH<0,ΔS<0,故选D。答案为:D;
(5)P4(s,白磷)+5O2 (g)= P4O10 (s)ΔH1=-2983.2 kJ/mol ①
4P(s,红磷)+ 5O2 (g) = P4O10 (s) ΔH2=-2954kJ/mol ②
利用盖斯定律,将①-②,即得该温度下白磷转化为红磷的热化学方程式P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol。答案为:P4(s,白磷)= 4P(s,红磷) ΔH=-29.2kJ/mol。