题目内容
【题目】硫酸亚铁铵是分析化学中重要的试剂,某实验小组制备和探究其分解产物的实验如下:I.制备硫酸亚铁铵
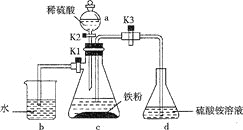
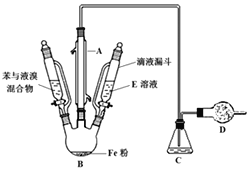
(1)仪器a的名称是__。
(2)将过量铁粉置于c中,加蒸馏水于b中,硫酸铵溶液于d中,按图连接好装置,打开K1、K2,关闭K3.使用铁粉“过量”的原因是___。
(3)关闭K1和K2,打开K3,c中浅绿色溶液流入d,其原因是___;d中析出沉淀,用化学方程式解释:___。
Ⅱ.探究硫酸亚铁铵的部分分解产物
假设气体产物仅有NH3、SO2、SO3(g)和H2O(g),设计如下所需装置进行实验;
已知:CaCl2+8NH3=CaCl2·8NH3
A.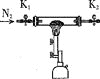 B.
B. C.
C.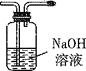 D.
D.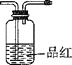 E.
E.![]()
①将I中制备的沉淀装入A,装置连接顺序为___,打开K1和K2,缓缓通入N2,一段时间后,关闭K1开始加热,实验后反应管中残留固体为红色粉末;
②B、D中有气泡冒出,还可观察到的现象分别为__,
③硫酸亚铁铵的分解方程式:___。
【答案】分液漏斗 确保生成的硫酸亚铁不会被氧化 关闭K1和K2,随着c中气体量的增加,将c中溶液压入d中 FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)2↓ EBDC 产生白色沉淀、品红溶液褪色 2(NH4)2Fe(SO4)2![]() 4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑
4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑
【解析】
I.(1)根据装置图书写仪器a的名称;
(2)铁粉过量,可保证生成的气体将锥形瓶中空气排出,确保硫酸亚铁不会被氧化;
(3)关闭K1和K2,随着c中气体量的增加,可将c中溶液压入d中, FeSO4溶液与(NH4)2SO4溶液混合后生成(NH4)2Fe(SO4)2,常温下(NH4)2Fe(SO4)2溶解度较小,以沉淀形式析出;
Ⅱ.①硫酸亚铁铵受热分解后生成的气体有NH3、SO2、SO3(g)和H2O(g),先用CaCl2吸收气体产物中的NH3和H2O,再用BaCl2溶液鉴定并吸收SO3,剩余的SO2能使品红溶液褪色,最后用氢氧化钠溶液吸收;
②B中SO3与氯化钡反应生成白色沉淀,D中SO2使品红溶液褪色;
③硫酸亚铁铵受热分解生成氨气、水、SO2、SO3和Fe2O3。
I.(1)根据装置图可得a的名称为分液漏斗;
(2)过量的铁粉能确保生成的硫酸亚铁不会被氧化,还能够排出锥形瓶中的氧气;
(3)关闭K1和K2,随着c中气体量的增加,可将c中溶液压入d中,发生反应;FeSO4溶液与(NH4)2SO4溶液混合后生成(NH4)2Fe(SO4)2,常温下(NH4)2Fe(SO4)2溶解度较小,以沉淀形式析出,故反应方程式为:FeSO4+(NH4)2SO4=(NH4)2Fe(SO4)2↓;
Ⅱ.①固体CaCl2的作用是吸收气体产物中的NH3和H2O,BaCl2溶液鉴定并吸收SO3,品红鉴定SO2,最后NaOH溶液的作用是处理尾气,所以装置的连接顺序是EBDC;
②B、D中的现象分别是产生白色沉淀、品红溶液褪色;
③根据实验后反应管中残留固体为红色粉末,可推测固体产物为Fe2O3,由题干知气体产物有NH3、SO2、SO3(g)和H2O(g),故化学方程式为2(NH4)2Fe(SO4)2![]() 4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑。
4NH3↑+Fe2O3+SO2↑+3SO3↑+2H2O↑。