题目内容
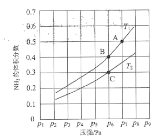
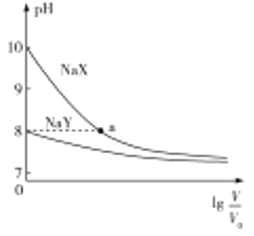
【题目】常温下,两种钠盐![]() 、
、![]() 溶液的物质的量浓度均为
溶液的物质的量浓度均为![]() ,加水稀释时溶液的
,加水稀释时溶液的![]() 与稀释倍数的对数
与稀释倍数的对数![]() 的关系如图所示。下列判断错误的是( )
的关系如图所示。下列判断错误的是( )
A.![]() 、
、![]() 均为弱酸,且
均为弱酸,且![]() 的酸性比
的酸性比![]() 的强
的强
B.![]() 的
的![]() 、
、![]() 溶液中,前者对水的电离促进作用较大
溶液中,前者对水的电离促进作用较大
C.![]() 点
点![]() 溶液中存在:
溶液中存在:![]()
D.随着溶液的稀释,![]() 溶液中
溶液中![]() 逐渐减小
逐渐减小
【答案】A
【解析】
A.根据图象可知,没有加水稀释时,0.1molL-1NaX、NaY溶液的pH均大于7,说明![]() 、
、![]() 均为弱酸,且pH:NaX>NaY,则酸性:HY>HX,故A错误;
均为弱酸,且pH:NaX>NaY,则酸性:HY>HX,故A错误;
B.酸性HY>HX,![]() 的
的![]() 、
、![]() 溶液中,NaX的水解程度大,水的电离促进作用较大,故B正确;
溶液中,NaX的水解程度大,水的电离促进作用较大,故B正确;
C.![]() 点
点![]() 溶液中存在电荷守恒,c(Na+)+ c(H+)= c(X-)+ c(OH-),pH=8,c(H+)<c(OH-),则
溶液中存在电荷守恒,c(Na+)+ c(H+)= c(X-)+ c(OH-),pH=8,c(H+)<c(OH-),则![]() ,故C正确;
,故C正确;
D.随着溶液的稀释,![]() 溶液的pH逐渐减小,促进
溶液的pH逐渐减小,促进![]() 溶液的水解,溶液中的c(Y-)的减小程度大于c(HY),则
溶液的水解,溶液中的c(Y-)的减小程度大于c(HY),则![]() 逐渐减小,故D正确;
逐渐减小,故D正确;
故选A。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目