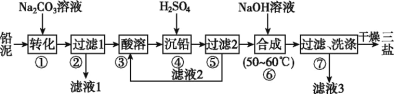
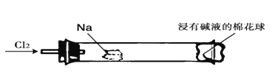
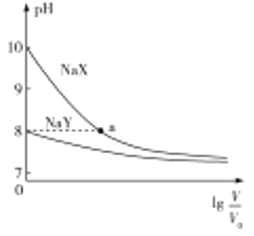
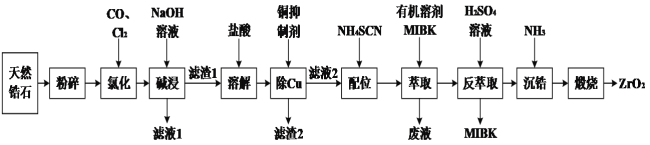
题目内容
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
【答案】C
【解析】
A. 依据化学平衡移动原理,结合影响因素分析判断;
B.可根据反应物的浓度改变与平衡移动的关系,结合含N元素的化合物分析;
C.根据可逆反应达到平衡时,任何物质的浓度不变分析;
D.催化剂能加快反应速率,但不影响平衡的移动。
A.由于该反应的正反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,所以升高温度可使该反应的平衡常数减小,A错误;
B.NH3是反应物,增大反应物的浓度,可以使平衡正向移动,NO的转化率提高,而NH3的转化率降低,B错误;
C.根据方程式可知,在任何条件下每反应消耗1molNO,会同时产生2molN2,现在单位时间内消耗NO和N2的物质的量比为1:2,说明正反应速率与逆反应速率相等,则NO、N2的浓度不变,因此反应达到平衡状态,C正确;
D.在其他条件不变时,使用高效催化剂,可以加快化学反应速率,但由于对正、逆反应速率的影响相同,所以平衡不发生移动,因此废气中氮氧化物的转化率不变,D错误;
故合理选项是C。

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目